
Acido acetilsalicilico
| Acido acetilsalicilico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
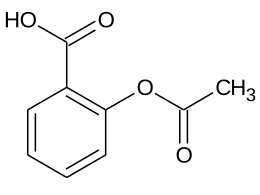
| acido 2-(acetilossi)benzoico | |
| Nomi alternativi | |
| acido acetilsalicilico ASA | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C9H8O4 |
| Massa molecolare (u) | 180,16 |
| Aspetto | polvere cristallina incolore |
| Numero CAS | 50-78-2 |
| Numero EINECS | 200-064-1 |
| Codice ATC | A01AD05 |
| PubChem | 2244 |
| DrugBank | DB00945 |
| SMILES |
CC(=O)Oc1ccccc1C(=O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,35 |
| Costante di dissociazione acida a 298 K | 3,2 × 10−4 |
| Solubilità in acqua | 3,0 g/L a 293 K |
| Temperatura di fusione | 136 °C (409 K) |
| Temperatura di ebollizione | 140 °C (413 K) con decomposizione |
| ΔcombH0 (kJ·mol−1) | -815,6 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −815,6 |
| Dati farmacologici | |
| Categoria farmacoterapeutica | antiaggregante - analgesico - antinfiammatorio - antipiretico |
| Teratogenicità | rischioso negli ultimi tre mesi di gravidanza, su consiglio del medico |
| Modalità di somministrazione |
orale |
| Dati farmacocinetici | |
| Biodisponibilità | dal 50% al 75% |
| Legame proteico | 99,6% |
| Metabolismo | epatico |
| Emivita | Dipendente dalla dose: 300–650 mg: 3,1–3,2 ore;
1 g: 5 ore; 2 g: 9 ore |
| Escrezione | renale |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 302 - 315 - 319 - 335 |
| Consigli P | 261 - 305+351+338 |

L'acido acetilsalicilico o ASA (comunemente noto con il nome commerciale di Aspirina, italianizzato da Aspirin, il primo nome commerciale di larga diffusione tedesco) è un farmaco antinfiammatorio non-steroideo (FANS) della famiglia dei salicilati.
Indice
Storia
Erodoto nelle Storie narrava che esisteva un popolo stranamente più resistente di altri alle comuni malattie, che era solito mangiare le foglie di salice. Ippocrate, considerato il padre della medicina, descrisse nel V secolo a.C. una polvere amara estratta dalla corteccia del salice che era utile per alleviare il dolore e abbassare la febbre. Un rimedio simile è citato anche dai sumeri, dagli antichi egizi e dagli assiri. Anche i nativi americani lo conoscevano e lo usavano per curare mal di testa, febbre, dolori muscolari, reumatismi e brividi.
Nell'era moderna è stato il reverendo Edward Stone, nel 1757, a scoprire gli effetti benefici della corteccia di salice, da lui assaggiata, oltre al suo sapore amaro. Sei anni dopo scrisse una famosa lettera alla Royal Society in cui giustificava in modo razionale l'utilizzo della sostanza contro le febbri.
La sostanza attiva dell'estratto di corteccia del salice bianco (Salix alba), chiamato salicina, fu isolata in cristalli nel 1828 da Johann A. Buchner e in seguito da Henri Leroux, un farmacista francese, e da Raffaele Piria, un chimico calabrese emigrato a Parigi, che diede al composto il nome attuale (acide salicylique). La salicina è abbastanza acida quando viene sciolta in acqua (una sua soluzione satura ha pH 2,4), per questo venne ribattezzata acido salicilico. Il composto fu isolato anche dai fiori di olmaria (Spiraea ulmaria) da alcuni ricercatori tedeschi, come Karl Jakob Löwig, nel 1839.
Nel 1860 Hermann Kolbe e i suoi studenti dell'Università di Marburgo riuscirono a sintetizzare l'acido salicilico, immettendolo poi sul mercato nel 1874 a un prezzo dieci volte inferiore all'acido estratto dalla salicina e già nel 1876 un gruppo di scienziati tedeschi, tra cui Franz Stricker e Ludwig Riess, pubblicarono su The Lancet gli esiti delle loro terapie basate sulla somministrazione di sei grammi di salicilati al giorno.
Secondo la storia maggiormente nota, nel 1897 Felix Hoffmann, seguendo l'idea del suo superiore Arthur Eichengrün, entrambi chimici impiegati presso la Friedrich Bayer & Co. esterificò il gruppo ossidrilico (-OH) dell'acido salicilico con un gruppo acetile (-COCH3) utilizzando anidride acetica. Ottenne così l'acido acetil-salicilico e acido acetico come sottoprodotto (Acetilazione). Questo composto presentava gli stessi effetti terapeutici dell'acido salicilico, ma con minori effetti collaterali. Soltanto alla fine del XX secolo si conobbero le controversie sulla paternità della molecola: il primato in ambito tedesco di Eichengrün e la precedente sintesi di Gerhardt in Francia. Nacquero così il primo farmaco sintetico, una molecola nuova e non una copia di una molecola già esistente in natura, e la moderna industria farmaceutica.
Il meccanismo di azione dell'aspirina fu conosciuto in dettaglio solamente nel 1970.
Caratteristiche strutturali e fisiche
L'acido acetilsalicilico puro si presenta a temperatura ambiente come un solido dai cristalli incolori. Il composto è assai scarsamente solubile in acqua (3 g/L ovvero 0,3% circa) e molto solubile in etanolo. Proprio per ovviare alla scarsa solubilità in acqua l'industria farmaceutica ha sintetizzato alcuni sali maggiormente idrosolubili, tra cui l'acetilsalicilato di lisina la cui solubilità raggiunge e supera il 40%.
Sintesi
La scoperta dell'acido acetilsalicilico, composto principalmente di sintesi scarsamente presente in natura, è dovuta al chimico francese Charles Frédéric Gerhardt. Invece la sintesi industriale è tuttora fonte di controversie e vi è una polemica irrisolta tra Felix Hoffmann e Arthur Eichengrün sulla paternità della procedura di sintesi della molecola registrata commercialmente dalla Bayer. Charles Frédéric Gerhardt aveva sintetizzato questo composto già nel 1853 e ne aveva registrato in Francia il brevetto. La reazione prevedeva l'impiego di salicilato di sodio, di origine vegetale, e cloruro di acetile, sintetico; nel 1859, Von Gilm sintetizzò l'acido acetilsalicilico con acido salicilico e cloruro di acetile e nel 1869 vennero variamente ripetute entrambe le sintesi dimostrando l'identità del prodotto di reazione.
L'acido acetilsalicilico può essere prodotto anche mediante sintesi di Kolbe: il fenolo viene deprotonato trattando con base forte, poi viene sottoposto a carbossilazione e acidificando forma l'acido salicilico che reagisce con anidride acetica formando così l'acido acetilsalicilico.
Farmacodinamica

In una ricerca che gli valse il premio Nobel 1982 per la medicina, insieme a Sune K. Bergström e Bengt I. Samuelsson "for their discoveries concerning prostaglandins and related biologically active substances", il londinese John Vane dimostrò i meccanismi dell'organismo umano che bloccano la produzione delle prostaglandine e dei trombossani a opera di un'inibizione enzimatica. L'inibizione avviene perché l'enzima cicloossigenasi, coinvolto nella loro sintesi, viene irreversibilmente acetilato a opera di una reazione coinvolgente l'acido acetilsalicilico, rendendolo non più funzionale.
Le prostaglandine sono ormoni locali prodotti dal corpo e assolvono a svariate funzioni, tra cui vi sono la trasmissione del segnale del dolore al cervello e la modulazione della temperatura corporea a livello dell'ipotalamo.
Ricerche più recenti hanno dimostrato che esistono due tipi di cicloossigenasi, COX-1 e COX-2: la COX-1 è presente nelle piastrine e, venendo acetilata, subisce un'inattivazione irreversibile; la COX-2 si trova principalmente nelle cellule endoteliali e, essendo queste ultime provviste di nucleo, la neosintesi è possibile. L'uso di aspirina inibisce la formazione di trombossani da parte della COX-1, invece la sintesi di prostaglandine e prostacicline si ristabilisce abbastanza rapidamente, spostando la bilancia trombotica verso l'antiaggregazione piastrinica. Quindi l'aspirina è normalmente usata nelle patologie trombotiche come antiaggregante e viene chiamata Cardioaspirin.
Farmacocinetica
Il processo di detossificazione avviene, come per la maggior parte dei farmaci e delle sostanze xenobiotiche, nel fegato. La principale via con cui l'aspirina viene eliminata è costituita dalla reazione di coniugazione con acido glucuronico, un acido costituito da una molecola di D-glucosio con un gruppo carbossilico in C-6. L'aspirina (acido acetilsalicico) reagisce con l'acido uridin-difosfo-glucuronico (UDP-GlcUA) formando UDP (uridina difosfato) e Aspirina-β-glucuronide, che viene poi filtrata a livello renale ed eliminata per mezzo delle urine.
Impiego clinico
Il composto trova impiego solo, o associato ad altri principi e a moderatori degli effetti collaterali, come analgesico per dolori lievi, come antipiretico (per ridurre la febbre) e come antinfiammatorio. È classificato come farmaco antiaggregante; per il suo effetto sul sangue, è utilizzato a piccole dosi e a lungo termine contro gli attacchi cardiaci sia in via preventiva, sia come terapia antiaggregante a seguito di evento ischemico non emorragico di non particolare gravità.
In passato questi farmaci hanno trovato largo impiego nel combattere i sintomi dell'influenza; oggi si tende a ricorrere al paracetamolo in quanto antipiretico, ma se assunto ad alte dosi presenta epatotossicità, oppure ad altri FANS, come per esempio l'ibuprofene, che in alcuni casi hanno effetti epatotossici e gastrolesivi meno pronunciati.
Un basso dosaggio di acetilsalicilati a lungo termine blocca irreversibilmente la formazione del trombossano A2 nelle piastrine, con un conseguente effetto inibitore sull'aggregazione delle piastrine. Questa proprietà la rende utile per ridurre l'incidenza degli infarti. Farmaci prodotti a questo scopo sono solitamente confezionati in compresse da 100 mg di principio attivo, e forti dosi sono spesso prescritte immediatamente dopo attacchi cardiaci acuti.
Una ricerca della Oxford University su 25 000 pazienti ha mostrato nel 2010 che una bassa dose di acido acetilsalicilico - 75 mg - assunta quotidianamente per un periodo tra i quattro e gli otto anni riduce sostanzialmente il tasso di morte di almeno un quinto per comuni forme di tumore indipendentemente dal sesso. Scendendo nel dettaglio la riduzione è del 40% per il cancro all'intestino, del 30% per quello ai polmoni, 10% per la prostata e 60% per il cancro all'esofago, mentre le riduzioni nel cancro al pancreas, stomaco, cervello, seno e ovaie sono state difficili da quantificare a causa dell'insufficienza dei dati, sebbene si stiano effettuando ulteriori studi al riguardo.
I trombossani sono coinvolti nel processo di coagulazione del sangue, essenziali quindi per l'emostasi. Gli attacchi cardiaci sono principalmente dovuti all'ostruzione dei vasi sanguigni da parte di grumi di sangue coagulato. L'uso di una piccola quantità di aspirina quotidianamente porta a una riduzione del numero dei coaguli: infatti molti farmaci costituiti da pasticche da 100 mg di aspirina (Cardioaspirin) sono somministrati a una parte delle persone anziane, soprattutto cardiopatici, con lo scopo di prevenire un'ostruzione arteriosa dovuta a formazione di trombi e in prevenzione secondaria, cioè dopo un evento come infarto del miocardio o sindrome coronarica acuta.
Nella prevenzione primaria, cioè in persone che non hanno avuto eventi cardiovascolari, non è al momento consigliata, poiché a fronte di una riduzione di infarto miocardico non fatale, l'assunzione non porta a una riduzione della morte cardiovascolare totale, ma incrementa invece i sanguinamenti clinicamente importanti.
Effetti collaterali
L'effetto collaterale più importante è una minore capacità del sangue di coagularsi, che si traduce in un'emorragia più abbondante in determinate situazioni (emorragia perioperatoria, mestruazioni, epistassi recidivante, eccetera). In Italia la donazione del sangue è consentita solo se sono passati almeno 5-7 giorni dall'ultima assunzione del farmaco.
Effetti collaterali indesiderati, specialmente ad alti dosaggi per assunzione a stomaco vuoto, riguardano il tratto gastro-intestinale, dove si possono avere ulcere ed emorragie. Il meccanismo di azione coinvolge la riduzione della sintesi di sostanze che proteggono la mucosa gastrica. Per ridurre questi effetti spesso vengono aggiunti composti di natura basica, o a effetto tampone, nonché associati farmaci a effetto gastro protettivo o/e inibitori della pompa idrogenionica cellulare, o simili inibitori della secrezione cloridrica.
Nel corso degli anni sono stati messi a punto nuovi farmaci antinfiammatori non steroidei (FANS), chiamati inibitori selettivi della COX-2 (come i Coxib), caratterizzati da una marcata riduzione degli effetti collaterali a carico del sistema gastro-intestinale. D'altro canto, con la COX-2 inibita, aumenta la sintesi di trombossani da parte delle piastrine, tramite la COX-1 ancora attiva. Questo sposta la bilancia trombotica verso l'aggregazione piastrinica, favorendo il formarsi di coaguli e l'instaurarsi di patologie cardiovascolari gravi. Questa è la motivazione per cui molti Coxib, come Rofecoxib e Valdecoxib, sono stati ritirati dal commercio. Questo tipo di farmaco viene utilizzato in terapia solo dietro prescrizione medica e solo qualora il medico curante lo ritenga strettamente necessario (vedi Etoricoxib e Celecoxib).
Il nome Aspirin

Il nome "aspirin", a indicare la propria produzione industriale di acido acetilsalicilico, fu brevettato dalla Bayer il 6 marzo 1899, componendo il prefisso "a-" (per il gruppo acetile) con "-spir-" (dal fiore Spiraea ulmaria, da cui si ricava l'acido spireico, ovvero l'acido salicilico) e col suffisso "-in", generalmente usato per i farmaci all'epoca.
Tuttavia la Bayer perse il diritto a usare il proprio marchio in molte nazioni dopo che gli Alleati occuparono e rivendettero le sue proprietà dopo la prima guerra mondiale. Il diritto a usare il marchio "Aspirin" negli Stati Uniti fu acquistato nel 1918 dalla Sterling Drug Inc. Già nel 1917, prima ancora che il brevetto scadesse, la Bayer non riuscì a impedire che il nome e la formula del farmaco fossero impiegati da altri. Sul mercato apparvero quindi "Aspirine" prodotte da numerose e diverse case farmaceutiche, finché nel 1921 una sentenza della corte federale degli Stati Uniti fece di "aspirin" un nome generico non più soggetto a brevetto. L'aspirina, così come l'eroina, non fu quindi un marchio registrato.
In altre nazioni, tra cui l'Italia e il Canada, il nome "Aspirina" è invece ancora un marchio registrato. Acido acetilsalicilico e acetilsalicilati, puri o in combinazione con eccipienti, sinergici e/o moderatori degli effetti collaterali si trovano sotto diversi nomi commerciali come analgesici antipiretici e antiaggreganti: secondo il prontuario farmaceutico nazionale, con i nomi di Ascriptin, Aspegic, Aspidol, CardioAspirin, Flectadol, Vivin C e diversi altri tra i parafarmaci non censiti dal prontuario.
Secondo un'altra teoria, il nome "Aspirina" deriva da "Aspreno", uno dei santi protettori della città partenopea, il cui culto è rimasto in voga fino agli anni '20 del secolo XX. Infatti, prima dell'uso tradizionale della compressa, buona parte della popolazione afflitta da mal di testa si recava nella chiesa omonima, sita nei pressi di Piazza della Borsa, ove inseriva il cranio ben rasato in una piccola teca in cui erano conservate le reliquie del Santo. Si narra che l'allora amministratore delegato dell'azienda Bayer, in visita nel capoluogo partenopeo, udì questa storia e al rientro in Germania diede alla molecola brevettata il nome che derivava da "Aspreno", Aspirina, appunto.
Voci correlate
Altri progetti
Altri progetti
-
 Wikiquote contiene citazioni sull'acido acetilsalicilico
Wikiquote contiene citazioni sull'acido acetilsalicilico
-
 Wikizionario contiene il lemma di dizionario «acido acetilsalicilico»
Wikizionario contiene il lemma di dizionario «acido acetilsalicilico» -
 Wikimedia Commons contiene immagini o altri file sull'acido acetilsalicilico
Wikimedia Commons contiene immagini o altri file sull'acido acetilsalicilico
Collegamenti esterni
- (EN) Acido acetilsalicilico, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Acetilazione dell'acido salicilico: sintesi dell'aspirina. (PDF), su pianetachimica.it.
- (EN) An aspirin a day keeps the doctor at bay. The world's first blockbuster drug is a hundred years old this week.
- (EN) Research in The 1990s: The Search for New Drugs.
- Riassunto delle caratteristiche del prodotto (AIFA). Dose da 325 mg.
- Riassunto delle caratteristiche del prodotto (AIFA). Dose da 100 mg.
- Linee guida per la gestione dello STEMI della società europea di cardiologia (PDF).
| Controllo di autorità | Thesaurus BNCF 1019 · LCCN (EN) sh85008731 · GND (DE) 4000351-6 · J9U (EN, HE) 987007295890305171 · NDL (EN, JA) 00577498 |
|---|