
Acido etilendiamminotetraacetico
| Acido etilendiamminotetraacetico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| N,N,N',N'-tetracarbossimetil-1,2-diamminoetano | |
| Abbreviazioni | |
| EDTA | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C10H16N2O8 |
| Massa molecolare (u) | 292,25 |
| Aspetto | solido cristallino da incolore a bianco |
| Numero CAS | 60-00-4 |
| Numero EINECS | 200-449-4 |
| PubChem | 6049 |
| DrugBank | DB00974 |
| SMILES |
C(CN(CC(=O)O)CC(=O)O)N(CC(=O)O)CC(=O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,86 |
| Solubilità in acqua | ~0,5 g/l a 20 °C |
| Temperatura di fusione | 220 °C (493 K) con decomposizione |
| Tensione di vapore (Pa) a 293 K | 1,3 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −1759,5 |
| Indicazioni di sicurezza | |
| Punto di fiamma | >100 °C (>373 K) |
| Temperatura di autoignizione | >200 °C (>473 K) |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 319 |
| Consigli P | 305+351+338 |
L'acido etilendiamminotetraacetico, più noto con la sigla di EDTA è un acido carbossilico; in particolare è un acido tetracarbossilico dotato inoltre di due doppietti elettronici (donatori di Lewis) appartenenti all'azoto. Queste caratteristiche fanno dell'anione etilendiamminotetraacetato EDTA4− un legante esadentato.
A temperatura ambiente si presenta come una polvere cristallina moderatamente solubile in acqua, cui impartisce una reazione acida: una sospensione di 10 grammi di EDTA in un litro di acqua ha pH circa 2,5. L'EDTA è viceversa solubile nelle soluzioni alcaline sotto forma di anione policarbossilato.
Fu sintetizzato per la prima volta nel 1935 dal chimico Ferdinand Münz.
Indice
Sintesi
Il composto fu descritto inizialmente da Ferdinand Münz, che lo preparò dalla reazione fra etilendiammina e acido cloroacetico. Oggi l'EDTA è sintetizzato essenzialmente a partire da etilendiammina (1,2-diamminoetano), formaldeide (metanale) e cianuro di sodio. Questa strada porta al sale sodico che può essere facilmente convertito in acido:
Così sono prodotte circa 80 000 tonnellate di EDTA all'anno. Le impurità cogenerate da questa via sintetica includono glicina e acido nitriloacetico, esse sono prodotte da reazioni secondarie dei coprodotti amminici.
Elementi di chimica di coordinazione dell'EDTA
Nella chimica di coordinazione, lo EDTA4− è un membro della famiglia di ligandi degli acidi poliammino carbossilici. EDTA4− abitualmente si lega a un catione metallico attraverso le sue due ammine e ai 4 carbossilati. Molti tra i composti di coordinazione adottano la geometria ottaedrica. Anche se di poca importanza per le sue applicazioni, questi complessi ottaedrici sono chirali. L'anione [Co(edta)]− è stato risolto nei suoi enantiomeri. Molti complessi dell'EDTA4− adottano strutture più complesse a causa di: (i) la formazione di un legame addizionale all'acqua, ad esempio complessi a sette-coordinate, oppure (ii) spiazzando uno dei bracci del carbossilato con una molecola d'acqua. Le prime ricerche sullo sviluppo dell'EDTA vennero eseguire da Gerold Schwarzenbach negli anni quaranta. EDTA forma complessi specialmente forti con Mn(II), Cu(II), Fe(III), Pb (II) e Co(III).
Alcune caratteristiche dei complessi formati dall'EDTA sono rilevanti per le sue applicazioni. Per prima istanza, a causa della sua alta denticità, questo ligando possiede un'alta affinità per i cationi metallici:
- [Fe(H2O)6]3+ + H4EDTA ⇄ [Fe(EDTA)]− + 6 H2O + 4 H+ (Keq = 1025,1)
Scritto in questa forma, la costante di equilibrio mostra che gli ioni metallici competono con i protoni per il legame all'EDTA. Dal momento che gli ioni metallici vengono estesamente avviluppati dall'EDTA, le loro proprietà catalitiche sono spesso soppresse. Inoltre, dal momento che i complessi del EDTA4− sono anionici, tendono a essere altamente solubili nella acqua acidula. Per questa ragione, l'acido etilen-diammino-tetra-acetico è capace di dissolvere i depositi di ossidi metallici e di carbonati.
Impieghi
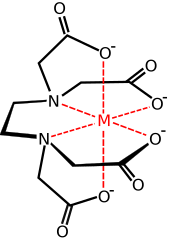
L'EDTA trova larghissimo impiego in chimica analitica come agente chelante, ad esempio nell'esame emocromocitometrico. La presenza di quattro gruppi carbossilici e di due atomi di azoto fa sì che la molecola di EDTA sia in grado di formare complessi stabili con moltissimi cationi.
La stabilità di questi complessi rende l'EDTA il reagente più diffuso per la misurazione della concentrazione di numerosi cationi tramite titolazione complessometrica. L'esempio più comune di applicazione di titolazioni di questo tipo è costituito dalla misura della durezza dell'acqua.
L'EDTA è infatti in grado di formare complessi con gli ioni di calcio e magnesio, ma anche con gli ioni di rame, zinco e numerosi altri elementi.
Nella pratica analitica quotidiana, più che l'acido libero, è frequente l'uso del suo sale calcio-disodico diidrato C10H14N2O8 Na2 Ca · 2 H2O, in particolare per la sua solubilità in acqua. Il calcio-disodio EDTA (CaNa-EDTA), da non confondere col disodio EDTA (DSEDTA), è l'unica forma di EDTA approvata dalla FDA come trattamento medico per la chelazione del piombo. Il disodio-EDTA è utilizzato in caso di ipercalcemia, per la sua maggiore affinità e capacità chelante verso il calcio. Stessa proprietà possiede il magnesio-EDTA, utilizzato come fertilizzante agricolo. Per questo motivo, nel flusso sanguigno svolgono una scarsa azione chelante, legandosi prima al calcio che ai metalli pesanti.
In cosmetica viene utilizzato come additivo per migliorare l'azione dei tensioattivi (diminuendo la durezza dell'acqua), per evitare l'irrancidimento dovuto alla contaminazione da ioni di ferro e come coadiuvante di altri additivi battericidi.
In odontoiatria e più specificatamente in endodonzia nel corso delle terapie canalari, le proprietà chelanti dell'EDTA sono utili nei lavaggi endocanalari, al fine di evitare la formazione dello smear-layer, il cosiddetto "fango dentinale," e ottenere così una detersione ottimale.
In farmacologia è usato per risolvere problemi di intossicazione con soluzioni in grado di chelare i metalli pesanti e formando un composto di più facile smaltimento. Infatti Il calcio-disodio-EDTA è più affine in ordine a mercurio, piombo, zinco (perciò inibitore della metalloproteasi), altri metalli pesanti e per ultimo al calcio. L'EDTA è scarsamente assorbito nel tratto gastrointestinale, per la maggior parte nel retto. Solamente tra il 5-15% entra nel sistema cardiovascolare dove può chelare e rimuovere le tossine dal sangue.
In elettrotecnica e di riflesso nell'automotive è un additivo idoneo a ridurre il fenomeno della solforazione (impropriamente solfatazione) sugli elettrodi nelle batterie al piombo acido ad acido libero ispezionabili.
Voci correlate
Altri progetti
Altri progetti
-
 Wikizionario contiene il lemma di dizionario «EDTA»
Wikizionario contiene il lemma di dizionario «EDTA» -
 Wikimedia Commons contiene immagini o altri file su acido etilendiamminotetraacetico
Wikimedia Commons contiene immagini o altri file su acido etilendiamminotetraacetico
Collegamenti esterni
- (EN) R.S. Lanigan e T.A. Yamarik, Final report on the safety assessment of EDTA, calcium disodium EDTA, diammonium EDTA, dipotassium EDTA, disodium EDTA, TEA-EDTA, tetrasodium EDTA, tripotassium EDTA, trisodium EDTA, HEDTA, and trisodium HEDTA, in Int. J. Toxicol., 21 Suppl 2, 2002, pp. 95–142, DOI:10.1080/10915810290096522, PMID 12396676.
- (EN) pH-Spectrum of EDTA complexes, su theoprax-research.com. URL consultato l'8 luglio 2009 (archiviato dall'url originale il 15 marzo 2007).
- (EN) EDTA: Molecule of the Month, su chm.bris.ac.uk.
- (EN) EDTA Determination of Total Water Hardness (PDF), su chem.utk.edu. URL consultato l'8 luglio 2009 (archiviato dall'url originale il 29 ottobre 2006).
- (EN) 507 references regarding oral EDTA, su gordonresearch.com. URL consultato l'8 luglio 2009 (archiviato dall'url originale il 23 marzo 2009).
- (EN) EDTA: the chelating agent under environmental scrutiny, su scielo.br, Química Nova, novembre-dicembre 2003.
- (EN) EDTA: the chelating agent under environmental scrutiny (PDF), su scielo.br, Química Nova, novembre-dicembre 2003.