
Aziridina
| Aziridina | |
|---|---|
 | |
 | |
 | |
| Nome IUPAC | |
| Aziridina | |
| Nomi alternativi | |
| Azaciclopropano, Etilene immina, Amminoetilene, Azirano, Dimetileneimmina, Dimetilenimmina, Etilimmina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C2H5N |
| Massa molecolare (u) | 43,07 |
| Aspetto | Chiaro, incolore, liquido oleoso odore simile-ammoniaca |
| Numero CAS | 151-56-4 Immagine_3D_aziridina |
| Numero EINECS | 205-793-9 |
| PubChem | 9033 |
| SMILES |
C1CN1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0.8321 g/mL 20 °C |
| Temperatura di fusione | −77.9 |
| Temperatura di ebollizione | 56 |
| Indicazioni di sicurezza | |
| Punto di fiamma | -11 (12 °F; 262 K) |
| Limiti di esplosione | 3.6–46% |
| Temperatura di autoignizione | 322 (612 °F; 595 K) |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | 351-315-335-334 |
| Consigli P | 201-280-262-260 |
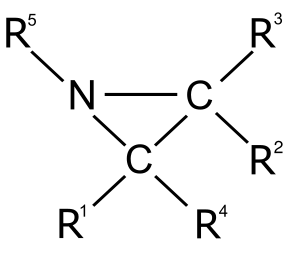
L’aziridina è un composto organico contenente il gruppo funzionale aziridina, un composto eterociclico con un'ammina (-NH-) e due gruppi di ponte metilene (-CH2-).
Le aziridine sono i composti derivati per sostituzione degli H con radicali organici.
Indice
Sintesi delle aziridine
Vi sono molti metodi di sintesi delle aziridine (aziridinazione).
Ciclizzazione di aloammine e amminoalcoli
Un gruppo funzionale ammina sposta l'alogeno adiacente in una reazione di sostituzione nucleofila intramolecolare per generare un'aziridina. Alcool ammine hanno la stessa reattività, ma prima bisogna convertire il gruppo idrossile in un buon gruppo uscente. La ciclizzazione di una alcool ammina viene detta sintesi di Wenker (1935), e quella di un'aloammina il metodo etilenimmina di Gabriel (1888).
Addizione di nitreni
Reazioni di addizione di nitreni ad alcheni è un metodo consolidato per la sintesi di aziridine. La fotolisi o la termolisi delle azidi sono un buon modo per generare i nitreni. I nitreni si possono anche preparare in situ da diacetato di fenilioduro(III) e solfonammidi, ad esempio il nitrene etossicarbonilnitrene dal precursore N-solfonilossi.

Decomposizione della triazolina
Il trattamento termico o la fotolisi della triazolina elimina azoto, producendo un'aziridina. Le triazoline vengono generate per cicloaddizione di alcheni con un'azide.

Epossidi
Un metodo implica la reazione ad anello aperto di un epossido con azoturo di sodio, seguita da riduzione organica dell'azoturo con trifenilfosfina accompagnata da espulsione di gas azoto:

L'altro metodo riguarda reazione ad anello aperto di epossidi con ammine, seguita da chiusura di anello con la reazione di Mitsunobu.
Ossime
La sintesi etilenimmina (aziridina) di Hoch-Campbell è la reazione di certe ossime con i reattivi di Grignard:

Alcheni usando il composto DPH
Nel 2014, è stato descritto un nuovo metodo per produrre aziridine facendo reagire alcheni sostituiti mono-, di-, tri- o tetra- con O-(2,4-dinitrofenil)idrossilammina (DPH o DPhHA) tramite solo un catalizzatore omogeneo al rodio. Questo metodo è operativamente semplice (i.e., one-pot) con resa eccellente.
Alchene + DPH 
Ad esempio, Ph-Aziridina-Me può essere sintetizzato con questo metodo e quindi convertirlo tramite reazione ad anello aperto a (D)-amfetamina e (L)-amfetamina (i due ingredienti attivi nel farmaco Adderall).
Reazioni
Apertura dell'anello nucleofilo
Le aziridine sono substrati reattivi nelle reazioni di apertura dell'anello con molti nucleofili a causa della loro tensione d'anello. L'alcolisi e l'aminolisi sono fondamentalmente reazioni inverse delle ciclizzazioni. Nucleofili di carbonio come i reattivi di organo-litio e gli organocuprati sono molto efficaci.
Un'applicazione di una reazione ad anello-aperto in sintesi asimmetrica è quella del trimetilsililazide TMSN3 con un ligande asimmetrico nell'immagine seguente nella sintesi organica dell'oseltamivir:

Formazione degli 1,3-dipolo
Certe azirine N-sostituite con un gruppo di prelievo di elettroni su entrambi gli atomi di carbonio formano degli iluri azometino in una reazione elettrociclica termica o in una reazione ad anello aperto fotochimica. Questi iluri possono essere intrappolati con un adatto dipolarofilo in una reazione di cicloaddizione 1,3-dipolare.:
Quando l'N-sostituente è un gruppo di prelievo di elettroni come il gruppo Ts, si rompe il legame carbonio-azoto, formando una molecola zwitterione di formula TsN−–CH2–CH+2–R
Questo tipo di reazione richiede un catalizzatore acido di Lewis come il trifluoruro di boro. In questo modo il 2-fenil-N-tosilaziridine reagisce con alchini, nitrili, chetoni e alcheni. Certi 1,4-dipoli si formano dalle azetidine.
Altre
Le aziridine N-nonsostituite possono essere aperte con le olefine in presenza di un acido di Lewis forte come B(C6F5)3.
Tossicologia
La tossicologia di un particolare composto aziridinico dipende dalla sua struttura e attività, pur condividendo le caratteristiche generali delle aziridine. Come un elettrofilo, le aziridine sono soggette all'attacco e all'apertura dell'anello da parte di nucleofili endogeni come le basi azotate in coppie di basi di DNA, con conseguente potenziale mutagenico.
Esposizione
Inalazione e contatto diretto sono le principali vie di esposizione. Alcuni rapporti notano che l'uso di guanti non ha impedito la permeazione dell'aziridina. È quindi importante che gli utenti controllino i tempi di permeazione dei guanti e con attenzione scrupolosa per evitare la contaminazione durante il trattamento delle lesioni da sguantamento della mano. Ai lavoratori che maneggiano l'azidirina ci si aspetta che venga fornito, e richiesto per indossare e usare, un respiratore con filtro a mezza maschera per polveri, nebbie e fumi.
Esistono relativamente pochi dati sull'esposizione umana all'aziridina. Questo perché è considerata estremamente pericolosa. In ambienti industriali, le tute di pressione di classe A sono preferite quando vi è possibilità di esposizione.
Cancerogenicità
L'IARC ha esaminato i composti dell'aziridina e li ha classificati come possibili cancerogeni per gli esseri umani ( IARC Gruppo 2B). Nel fare la valutazione complessiva, il gruppo di lavoro IARC ha evidenziato che l'aziridina è un agente alchilante ad azione diretta ed è mutageno in una vasta gamma di sistemi di test e forma addotti di DNA che sono promutagenici.
- Irritazione
Le aziridine sono irritanti per le superfici della mucosa inclusi occhi, naso, vie respiratorie e pelle.
- Sensibilizzazione
L'aziridina penetra rapidamente nella pelle al contatto.
- Sensibilizzante cutaneo - causa dermatite allergica da contatto e orticaria.
- Sensibilizzante respiratorio - causa di asma professionale.
Voci correlate
- Etilenimmina binaria, una forma dimerica dell'aziridina
- Azirina
- Diazirina
- Diaziridina
Altri progetti
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su aziridina
Wikimedia Commons contiene immagini o altri file su aziridina

