
Carne coltivata

La carne coltivata (erroneamente chiamata carne sintetica, artificiale o in vitro) è un prodotto di carne animale originata dalle cellule staminali.
Nel XXI secolo, diversi progetti di ricerca sono riusciti nella produzione di carne in vitro nei laboratori. Il primo hamburger in vitro, creato da una squadra olandese, è stato mangiato ad una dimostrazione per la stampa a Londra ad agosto 2013. Rimangono diverse difficoltà da superare prima che la carne in vitro diventi disponibile in commercio. La carne coltivata è estremamente costosa, anche se ci si aspetta che il costo possa essere ridotto per competere con quello della carne ottenuta convenzionalmente grazie al miglioramento delle tecnologie. Alcune persone sostengono che sia necessario un sostanziale cambiamento nell'industria della carne: rispetto alla carne ottenuta tradizionalmente, la carne coltivata è preferibile sia da un punto di vista etico, dal momento che non richiede uccisioni e riduce i rischi di crudeltà sugli animali, ma soprattutto su quello economico, dato che riduce drasticamente l'impatto sia monetario che ambientale dell'industria della carne. Altri invece non condividono l'idea di mangiare carne che non si sia sviluppata naturalmente.
Indice
- 1 Storia
-
2 Tecnica
- 2.1 Linee cellulari
- 2.2 Bioreattori
- 2.3 Ingegneria tissutale
- 2.4 Porosità
- 2.5 Vascolarizzazione
- 2.6 Proprietà biochimiche
- 2.7 Cristallinità
- 2.8 Degrado
- 2.9 Commestibilità
- 2.10 Cellulosa
- 2.11 Chitina
- 2.12 Collagene
- 2.13 Micelio
- 2.14 Nanomateriali
- 2.15 Filatura
- 2.16 Produzione additiva
- 2.17 Fermentazione
- 3 Startup
- 4 Sfide per la ricerca
- 5 Differenze con la carne comune
- 6 Note
- 7 Voci correlate
- 8 Altri progetti
- 9 Collegamenti esterni
Storia
| (EN)
«We shall escape the absurdity of growing a whole chicken in order to eat the breast or wing, by growing these parts separately under a suitable medium.» |
(IT)
«Sfuggiremo all'assurdità di far crescere un pollo intero, solo per mangiarne il petto o l'ala, facendo crescere queste parti separatamente in un ambiente adatto.» |
| (Winston Churchill, Fifty Years Hence, The Strand Magazine (dicembre 1931)) | |
La possibilità teorica di coltivare carne in un ambiente industriale ha catturato a lungo l'immaginazione del pubblico. Nel suo saggio del 1931 Fifty Years Hence, Winston Churchill scrisse: "Sfuggiremo all'assurdità di far crescere un pollo intero per mangiare il petto o l'ala, coltivando queste parti separatamente in un mezzo adatto".
Negli anni '50 lo scienziato olandese Willem van Eelen ebbe l'idea della carne coltivata. Da bambino durante la seconda guerra mondiale Van Eelen soffriva la fame, e ciò l'ha portato ad appassionarsi alla produzione alimentare e alla sicurezza alimentare da adulto. Frequentò l'Università di Amsterdam. A un certo punto assistette a una conferenza sulle prospettive della carne conservata. Insieme alla scoperta sulle linee cellulari all'inizio del secolo, questo incentivò l'idea della carne coltivata.
La coltivazione in vitro delle fibre muscolari è stata effettuata la prima volta nel 1971 da Russell Ross. In particolare, il risultato era un tessuto muscolare liscio derivato dal maiale, e fatto crescere in coltura cellulare. La coltivazione in-vitro è possibile fin dagli anni novanta utilizzando le cellule staminali degli animali, includendo piccole quantità di tessuto che potrebbero essere in teoria cucinate e mangiate. La NASA ha condotto esperimenti fin dal 2001, producendo carne coltivata da cellule di tacchino. Il primo esempio commestibile è stato prodotto dallo NSR/Tuoro Applied BioScience Research Consortium nel 2002: cellule di pesce rosso fatte crescere fino a formare filetti di pesce.
Nel 1998 Jon F. Vein ha richiesto e ottenuto un brevetto negli Stati Uniti (US 6,835,390 B1) per la produzione di tessuti di carne artificiale per il consumo umano, dove cellule di muscoli e di grasso sarebbero state fatte crescere in un sistema di produzione integrato per creare prodotti alimentari come bistecche, polpette e pesce.
Nel 2001 il dermatologo Wiete Westerhof dell'Università di Amsterdam, il Dott. Willem van Eelen, e l'imprenditore Willem van Koten hanno annunciato di aver presentato la richiesta per un brevetto internazionale per un processo di produzione di carne coltivata. Nel processo, in una matrice di collagene vengono innestate cellule muscolari, che sono messe a bagno in una soluzione nutritiva e indotte a dividersi. I ricercatori di Amsterdam studiano il mezzo di coltura, mentre all'Università di Utrecht studiano la proliferazione delle cellule muscolari e all'Università della Tecnologia di Eindhoven vengono cercati bioreattori.
Nel 2003 Oron Catts e Ionat Zurr, del Tissue Culture and Art Project e l'Harvard Medical School hanno esibito a Nantes una "bistecca", larga qualche centimetro, prodotta attraverso cellule staminali della rana, che è stata cucinata e mangiata.
Il primo articolo di una rivista pubblicato sull'argomento è apparso nel 2005 in un numero di "Tissue Engineering".
Nel 2008 la PETA ha offerto un premio di 1 milione di dollari per la prima azienda che avesse fornito ai consumatori entro il 2012 carne di pollo coltivata. Il governo olandese ha investito 4 milioni di dollari negli esperimenti riguardanti la carne artificiale. Lo "In Vitro Meat Consortium", un gruppo formato da ricercatori internazionali interessati alla tecnologia, ha tenuto la prima conferenza internazionale sulla produzione di carne in vitro, ospitata al "Food Research Institute" della Norvegia ad aprile 2008, per discutere le possibilità commerciali. La rivista Time ha dichiarato che la produzione di carne coltivata sarebbe stata una delle 50 idee rivoluzionarie del 2009. A novembre 2009, ricercatori olandesi hanno annunciato di essere riusciti a far crescere carne in laboratorio utilizzando cellule di un maiale vivo.
Nel 2012, 30 laboratori in tutto il mondo hanno annunciato che stanno lavorando sulla carne coltivata. Il soprannome inglese dato alla carne creata in laboratorio dalla coltura di tessuti animali è "Shmeat" dalla combinazione di "sheet" e "meat".
Il 27 aprile 2022 la Commissione Europea ha approvato la richiesta di raccolta firme per l'iniziativa dei cittadini europei End The Slaughter Age per spostare i sussidi dalla zootecnia all'agricoltura cellulare..
Prima dimostrazione pubblica
Il 5 agosto 2013, il primo hamburger prodotto in laboratorio al mondo è stato cucinato e mangiato in una conferenza stampa a Londra. Gli scienziati della Maastricht University in Olanda, guidati dal Prof. Mark Post, hanno preso cellule staminali da una mucca e le hanno fatte crescere fino a formare strisce muscolari che hanno combinato per produrre un hamburger. La carne è stata cucinata dal cuoco Richard McGeown del Couch's Great House Restaurant a Polperro, in Cornovaglia, ed assaggiata dal critico culinario Hanni Ruetzler, uno studioso di alimentazione dal Future Food Studio, e da Josh Schonwald. Ruetzler ha constatato che non essendoci grassi non è succosa, e pertanto il gusto non è il migliore possibile, tuttavia sente del sapore intenso. Ha aggiunto che si avvicina alla carne, anche se meno saporita, ma ne giudica la consistenza perfetta. In conclusione: "Per me è carne, è qualcosa che posso masticare e credo che l'aspetto sia decisamente simile". Ha inoltre dichiarato che in un test ad occhi chiusi avrebbe preso il prodotto per carne piuttosto che per un derivato della soia.
Il tessuto per la dimostrazione di Londra è stato coltivato a maggio 2013, utilizzando almeno 20000 strisce sottili di tessuto muscolare prodotto in laboratorio. Donazioni per circa 250.000 € sono giunte da un donatore anonimo, in seguito rivelatosi essere Sergey Brin. Il Prof. Mark Post ha dichiarato che non ci sono ragioni per cui non potrebbe essere più economica, e che sarebbe molto contento di ridurre di un milione di volte i capi di bestiame in tutto il mondo. Sempre Post ha stimato che probabilmente ci vorrà almeno un decennio prima che il processo sia commercialmente valido.
Entrata nel mercato
Nell'Unione europea i nuovi alimenti come i prodotti a base di carne coltivata devono passare attraverso un periodo di prova di circa 18 mesi durante il quale un'azienda deve dimostrare all'Autorità europea per la sicurezza alimentare (EFSA) che il loro prodotto è sicuro.
Il 2 dicembre 2020, la Singapore Food Agency ha approvato per la vendita commerciale i "bocconcini di pollo" prodotti da Eat Just. Per la prima volta un prodotto a base di carne coltivata ha superato la revisione della sicurezza (che ha richiesto 2 anni) da parte di un organo di controllo alimentare. Questo è stato ampiamente considerato una pietra miliare per l'industria alimentare. I pezzi di pollo erano programmati per l'introduzione nei ristoranti di Singapore.
Tecnica
Linee cellulari

La tecnica consiste nel prelevare cellule muscolari e nutrirle con proteine che aiutano la crescita del tessuto. Una volta che il processo è partito, teoricamente è possibile continuare a produrre carne all'infinito senza aggiungere nuove cellule da un organismo vivente. Si è stimato che, in condizioni ideali, due mesi di produzione di carne in vitro potrebbero generare 50.000 tonnellate di carne da dieci cellule muscolari di maiale.
Bioreattori

La carne coltivata può essere prodotta come strisce di fibra muscolare, che cresce attraverso la fusione di cellule staminali embrionali, cellule staminali adulte o cellule satellite specializzate trovate nel tessuto muscolare. Questo tipo di carne può essere coltivata in un bioreattore.
Alternativamente, la carne potrebbe crescere in un muscolo "reale". Tuttavia, questo richiederebbe qualcosa che sostituisca il sistema circolatorio, con lo scopo di fornire i nutrienti e l'ossigeno direttamente alle cellule che stanno crescendo, e di rimuovere i prodotti di scarto. Si dovrebbero produrre anche altri tipi di cellule, come adipociti, e messaggeri chimici dovrebbero fornire le istruzioni ai tessuti in crescita per la formazione di strutture. Il tessuto muscolare si dovrebbe anche "stirare" fisicamente, o dovrebbe venir "esercitato" al fine di farlo crescere correttamente.
Ingegneria tissutale

Nel caso dei prodotti strutturati a base di carne (prodotti caratterizzati dalla loro configurazione complessiva e dal tipo di cellule) le cellule devono essere seminate su scaffold (ovvero delle impalcature tridimensionali, di varia natura, che sostengono l'architettura cellulare). Essi sono essenzialmente stampi destinati a riflettere e incoraggiare le cellule a organizzarsi in una struttura più ampia. Quando le cellule si sviluppano in vivo, sono influenzate dalle loro interazioni con la matrice extracellulare (ECM). L'ECM è la rete tridimensionale di glicoproteine, collagene ed enzimi responsabili della trasmissione di segnali meccanici e biochimici alla cellula. Gli scaffold devono simulare le caratteristiche dell'ECM.
Porosità
I pori sono minuscole aperture sulla superficie degli scaffold. Possono essere creati sulla superficie del biomateriale per rilasciare componenti cellulari che potrebbero interferire con lo sviluppo dei tessuti. Aiutano anche a diffondere gas e sostanze nutritive agli strati più interni delle cellule aderenti, prevenendo lo sviluppo di un "centro necrotico" (creato quando le cellule che non sono a diretto contatto con il terreno di coltura muoiono a causa della mancanza di sostanze nutritive).
Vascolarizzazione

Il tessuto vascolare che si trova nelle piante contiene gli organi responsabili del trasporto interno dei fluidi. Forma topografie naturali che forniscono un modo a basso costo per promuovere l'allineamento cellulare replicando lo stato fisiologico naturale dei mioblasti. Può anche aiutare con lo scambio di gas e nutrienti.
Proprietà biochimiche
Le proprietà biochimiche di uno scaffold dovrebbero essere simili a quelle dell'ECM. Deve facilitare l'adesione cellulare attraverso qualità strutturali o legami chimici. Inoltre, deve produrre i segnali chimici che incoraggiano la differenziazione cellulare. In alternativa, il materiale dovrebbe essere in grado di mischiarsi con altre sostanze che hanno queste qualità funzionali.
Cristallinità

Il grado di cristallinità di un materiale determina qualità come la rigidità. L'elevata cristallinità può essere attribuita al legame idrogeno che a sua volta aumenta la stabilità termica, la resistenza alla trazione (importante per mantenere la forma dello scaffold), la ritenzione idrica (importante per l'idratazione delle cellule) e il modulo di Young.
Degrado
Alcuni materiali si degradano in composti benefici per le cellule, sebbene questa degradazione possa anche essere irrilevante o dannosa. La degradazione consente una facile rimozione dello scaffold dal prodotto finito lasciando solo tessuto animale, aumentando così la sua somiglianza con la carne in vivo. Questa degradazione può essere indotta dall'esposizione a determinati enzimi che non influiscono sul tessuto muscolare.
Commestibilità
Se gli scaffold non possono essere rimossi dal tessuto animale, devono essere commestibili per garantire la sicurezza del consumatore. Sarebbe utile se fossero fatti di ingredienti nutrienti.
Dal 2010 sono nati gruppi di ricerca accademici e aziende al fine di individuare materie prime che abbiano le caratteristiche di idonei scaffold.
Cellulosa

La cellulosa è il polimero più abbondante in natura e fornisce gli esoscheletri delle foglie delle piante. Data la sua abbondanza, può essere ottenuto a un costo relativamente basso. È anche versatile e biocompatibile. Attraverso un processo chiamato "decellularizzazione", viene ricoperto da un tensioattivo che crea dei pori. Questi pori rilasciano i componenti cellulari della pianta e diventa tessuto vegetale decellularizzato. Questo materiale è stato ampiamente studiato dai gruppi Pelling e Gaudette rispettivamente dell'Università di Ottawa e del Worcester Polytechnic Institute. Attraverso reticolazione (formando legami covalenti tra le singole catene polimeriche per tenerle insieme) le proprietà meccaniche del tessuto vegetale possono essere modificate in modo che assomigli maggiormente al tessuto muscolare. Questo può essere fatto anche mescolando il tessuto vegetale con altri materiali.
Chitina

La chitina è il secondo polimero più abbondante in natura. Si trova negli esoscheletri di crostacei e funghi. Poiché l'agricoltura cellulare sta tentando di porre fine alla dipendenza dagli animali, la chitina derivata dai funghi è di maggiore interesse. È stato per lo più studiato da Pelling Group. Il chitosano è derivato dalla chitina in un processo noto come deacetilazione alcalina (sostituendo alcuni gruppi di amminoacidi). Il grado di questo processo determina le proprietà fisiche e chimiche del chitosano. Il chitosano ha proprietà antibatteriche; in particolare, ha effetti battericidi sui batteri planctonici e sui biofilm e un effetto statico batterico sui gram negativi batteri come E. coli. Questo è importante in quanto neutralizza i composti potenzialmente dannosi senza l'uso di antibiotici, cosa che molti consumatori evitano. La somiglianza del chitosano con i glicosaminoglicani e le interazioni interne tra glicoproteine e proteoglicani lo rendono altamente biocompatibile. Può facilmente mescolarsi con altri polimeri per selezionare più fattori bioattivi. Un potenziale svantaggio del chitosano è che si degrada in presenza di lisozimi (enzimi naturali). Ma si può resistere a questo usando la deacetilazione. Questo non è del tutto negativo, poiché i sottoprodotti prodotti attraverso la degradazione hanno proprietà antinfiammatorie e antibatteriche. È importante abbinare il livello a cui le cellule si affidano alla matrice per la struttura con il degrado.
Collagene

Il collagene è una famiglia di proteine che costituisce la struttura primaria del tessuto connettivo umano. È tipicamente derivato da fonti bovine, suine e murine. L'agricoltura cellulare supera questa dipendenza attraverso l'uso di organismi transgenici in grado di produrre le ripetizioni di amminoacidi che compongono il collagene. Il collagene esiste naturalmente come collagene di tipo I. È stato prodotto come idrogel porosi, compositi e substrati con indicazioni topografiche e proprietà biochimiche. I tipi sintetici di collagene sono stati prodotti attraverso la produzione di proteine ricombinanti: collagene di tipo II e III, tropoelastina e fibronectina. Una sfida con queste proteine è che non possono essere modificate dopo la traduzione. Tuttavia, una proteina fibrillare alternativa è stata isolata nei microbi che mancano degli stimoli biochimici del collagene, ma ha il suo tipo di personalizzazione genica. Uno degli obiettivi della produzione di collagene ricombinante è l'ottimizzazione della resa: come può essere prodotto in modo più efficace. Le piante, in particolare il tabacco, sembrano l'opzione migliore, tuttavia anche batteri e lieviti sono valide alternative.
La proteina di soia testurizzata è un prodotto a base di farina di soia spesso utilizzato nella carne di origine vegetale che supporta la crescita delle cellule bovine. La sua consistenza spugnosa consente un'efficace semina cellulare e la sua porosità favorisce il trasferimento di ossigeno. Inoltre, si degrada durante la differenziazione cellulare in composti benefici per determinate cellule.
Micelio

Il micelio sono le "radici" dei funghi. Altast Foods Co. sta usando la fermentazione allo stato solido per far crescere il tessuto dei funghi su scaffold di micelio. Raccolgono questo tessuto e lo usano per creare analoghi della pancetta.
Nanomateriali

I nanomateriali mostrano proprietà uniche su scala nanometrica. Biomimetic Solutions, con sede a Londra, sta sfruttando i nanomateriali per creare scaffold.
Cass Materials a Perth, in Australia, sta utilizzando una fibra alimentare chiamata Nata de Coco (derivata dalle noci di cocco) per creare spugne di nanocellulosa per il suo scaffold BNC. Nata de Coco è biocompatibile, ha un'elevata porosità, facilita l'adesione cellulare ed è biodegradabile.
Filatura
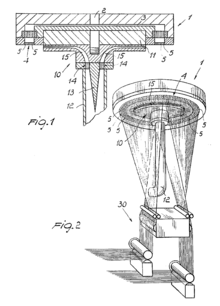
Immersion Jet Spinning è un metodo per creare scaffold mediante la filatura di polimeri in fibre, sviluppato dal Parker Group ad Harvard. La loro piattaforma utilizza la forza centrifuga per estrudere una soluzione polimerica attraverso un'apertura in un serbatoio rotante. Durante l'estrusione, la soluzione forma un getto che si allunga e si allinea mentre attraversa il traferro. Il getto viene diretto in un bagno di precipitazione controllato dal vortice che reticola chimicamente o precipita le nanofibre polimeriche. La regolazione del traferro, della rotazione e della soluzione modifica il diametro delle fibre risultanti. Questo metodo può far girare scaffold da fogli di PPTA, nylon, DNA e nanofibre. Uno scaffold di tipo nanofibrosa a base di alginato e la gelatina è stata in grado di supportare la crescita delle cellule C2C12. I mioblasti della muscolatura liscia dell'aorta di coniglio e bovino sono stati in grado di aderire alle fibre di gelatina. Formavano aggregati su fibre più corte e tessuti allineati su quelle più lunghe.
Produzione additiva

Un filamento di cellule muscolari può essere stampato in una struttura pensata per assomigliare a un prodotto a base di carne finito che può quindi essere ulteriormente lavorato per la maturazione cellulare. Questa tecnica è stata dimostrata in una collaborazione tra soluzioni di bioprinting 3D e Aleph Farms che hanno utilizzato la produzione additiva per strutturare le cellule di tacchino sulla Stazione Spaziale Internazionale.
La biostampa 3D è stata utilizzata per produrre carne coltivata simile a una bistecca, composta da tre tipi di fibre cellulari bovine e con una struttura di fibre cellulari assemblate simile alla carne originale.
Fermentazione

I prodotti utilizzati in questa tecnica includono latte, miele, uova, formaggio e gelatina che sono fatti di varie proteine piuttosto che di cellule. In tali casi, queste proteine devono essere fermentate in modo molto simile alla produzione di proteine ricombinanti, alla produzione di alcol e alla generazione di molti prodotti a base vegetale come tofu, tempeh e crauti. Le proteine sono codificate da geni specifici, i geni che codificano per la proteina di interesse sono sintetizzati in un plasmide, un anello chiuso di informazioni genetiche a doppia elica. Questo plasmide, chiamato DNA ricombinante, viene poi inserito in un campione batterico. Perché ciò avvenga, i batteri devono essere competenti (cioè in grado di accettare DNA estraneo, extracellulare) e in grado di trasferire geni orizzontalmente (cioè integrare i geni estranei nel proprio DNA). Il trasferimento genico orizzontale è significativamente più impegnativo negli organismi eucarioti rispetto a organismi procarioti perché i primi hanno sia una membrana cellulare che una membrana nucleare che il plasmide deve penetrare mentre gli organismi procarioti hanno solo una membrana cellulare. Per questo motivo, i batteri procarioti sono spesso favoriti. Al fine di rendere un tale batterio temporaneamente competente, può essere esposto a un sale come il cloruro di calcio, che neutralizza le cariche negative sulle teste di fosfato della membrana cellulare e le cariche negative sul plasmide per impedire che i due si respingano. I batteri possono incubare in acqua calda, aprendo grandi pori sulla superficie cellulare attraverso i quali può entrare il plasmide.
Successivamente, i batteri vengono fermentati nello zucchero, che lo incoraggia a crescere e duplicarsi. Nel processo esprime il suo DNA e il plasmide trasferito con conseguente proteina.
Infine, la soluzione viene purificata per separare la proteina residua. Questo può essere fatto introducendo un anticorpo generato contro la proteina di interesse che ucciderà le cellule batteriche che non contengono la proteina. Attraverso la centrifugazione, la soluzione può essere fatta ruotare attorno a un asse con una forza sufficiente per separare i solidi dai liquidi. In alternativa potrebbe essere immerso in una soluzione ionica tamponata che utilizza l'osmosi per lisciviare l'acqua dai batteri e ucciderli.
Startup
Il prezzo della carne coltivata nei negozi potrebbe decrescere rapidamente fino ad essere considerata "economica" dal consumatore medio grazie ai miglioramenti tecnologici.
Le tecniche di creazione della carne coltivata sono state approvate sin dal 1995 dalla Food and Drug Administration.
In linea teorica si può creare il tessuto muscolare di qualsiasi animale, incluso l'essere umano, aprendo la strada anche a possibili applicazioni mediche.
Tra il 2011 e il 2017 sono state lanciate molte startup di carne coltivata. Memphis Meats, una startup della Silicon Valley fondata da un cardiologo, ha lanciato un video nel febbraio 2016 che mostrava la sua polpetta di manzo coltivata. Nel marzo 2017 ha presentato le offerte di pollo e l'anatra all'arancia, il primo pollame coltivato mostrato al pubblico. Memphis Meats è stata in seguito oggetto del documentario Meat the Future del 2020.
Nel marzo 2018 Eat Just (fondata nel 2011 come Hampton Creek a San Francisco, in seguito nota come Just, Inc.) ha affermato di essere in grado di offrire un prodotto di consumo a base di carne coltivata. Nel 2021 ha annunciato di aprire una fabbrica in questione nel Qatar.
Nel 2019 Aleph farm ha collaborato con 3D Bioprinting Solutions per coltivare la carne sulla Stazione Spaziale Internazionale. Ciò è stato fatto estrudendo cellule di carne su uno scaffold utilizzando una stampante 3D.
L'azienda Hampton Creek ha dichiarato di poter prendere queste cellule direttamente da una semplice piuma, mentre l'azienda SuperMeat ha dichiarato di poter nutrire le cellule con sostanze sintetiche o di origine vegetale (invece del siero).
Leonardo DiCaprio nel 2021 ha dichiarato di supportare Mosa Meat e Aleph Farms dicendo "Per combattere la crisi climatica trasformare il nostro sistema alimentare".
Sfide per la ricerca
La scienza necessaria alla produzione di carne coltivata è derivata da una branca delle biotecnologie nota come ingegneria dei tessuti. La tecnologia viene sviluppata contemporaneamente per altri usi, come la ricerca contro la distrofia muscolare e la produzione di organi per trapianti. Vi sono diversi ostacoli da superare:
- Proliferazione delle cellule muscolari: nonostante non sia molto difficile far dividere cellule staminali, per la produzione di carne è necessario che lo facciano a gran velocità, producendo carne solida. Questo requisito ha diversi aspetti in comune con la branca medica dell'ingegneria del tessuti.
- Mezzo di coltura: la proliferazione delle cellule richiede una sorgente di cibo per crescere e svilupparsi. Il mezzo di crescita dovrebbe essere un insieme ben bilanciato di ingredienti e ormoni della crescita. I ricercatori hanno già identificato possibili mezzi di coltura per cellule muscolari di tacchino, pesce, pecora e maiale. In base agli obiettivi dei ricercatori, il mezzo di coltura può avere requisiti aggiuntivi
- Commerciali: deve essere economico da produrre
- Relativi al benessere degli animali: non deve aver bisogno di materiale animale (fatta eccezione per le cellule staminali da utilizzare al principio del processo)
- Anallergico: focalizzando l'attenzione sui tipi di piante utilizzati per il nutrimento per evitare possibili reazioni allergiche dei consumatori.
- Bioreattori: i nutrienti e l'ossigeno devono essere forniti direttamente a ciascuna cellula in crescita, sulla scala dei millimetri. Negli animali questo compito è portato a termine dai vasi sanguigni. Un bioreattore dovrebbe sopperire a questa mancanza in un modo efficiente. L'approccio tipico è quello di creare una matrice a forma di spugna in cui le cellule possano crescere ed essere immerse nel mezzo di coltura.
Differenze con la carne comune
Salute
I ricercatori hanno suggerito di inserire nella carne coltivata acidi grassi di Omega-3, per migliorare la salute dei consumatori. La carne in vitro è meno esposta a batteri e decomposizione, inoltre, essendo decisamente più controllata della carne convenzionale, è ridotta l'esposizione a sostanze chimiche tossiche come pesticidi e fungicidi. La produzione di carne in vitro richiede un conservante, come il sodio benzonato, per proteggere la carne in crescita da lieviti e funghi.
Ambiente
I ricercatori hanno mostrato come l'impatto ambientale della carne coltivata sia significativamente minore rispetto a quello della carne da macello. Per ogni ettaro utilizzato per la produzione di carne coltivata si potrebbero liberare tra i 10 e i 20 ettari di terra. Secondo studi di ricercatori di Oxford e di Amsterdam, la produzione di carne coltivata emetterebbe il 4% dei gas serra e ridurrebbe i consumi energetici per la produzione della carne del 45%, richiedendo solo il 2% di tutte le terre utilizzate per l'industria dell'allevamento. L'allevamento tradizionale è responsabile del 18% dei gas serra, e causa più danni dell'intero sistema mondiale dei trasporti. La produzione di carne coltivata potrebbe essere la scelta ideale per un mondo sovrappopolato, permettendo grandi risparmi di terra, energia e soprattutto acqua. Infine, riportando molta terra allo stato vergine si salverebbero un gran numero di animali selvatici.
Tuttavia la carne coltivata potrebbe recare, a lungo andare, più danno all'ambiente di quella tradizionale secondo uno studio britannico dei ricercatori della Oxford Martin School pubblicato su Frontiers in Sustainable Food Systems affermando che le emissioni di metano derivanti dagli allevamenti tradizionali restano in atmosfera per circa 12 anni. La produzione di carne coltivata, associata quasi esclusivamente a emissioni di CO2, potrebbe risultare ancora più pesante, poiché resta nell'atmosfera per millenni. Inoltre potrebbe comportare problemi di inquinamento del suolo, per via delle grandi quantità di sostanze chimiche, degli ormoni e dei fattori di crescita usati per coltivare le cellule iniziali. Lo studio però non va frainteso, in quanto dimostra che la produzione di CO2 del settore zootecnico non può essere ridotta con un miglioramento tecnologico, a differenza di quella prodotta con l'agricoltura cellulare. Sul sito della Oxford Martin School si legge infatti:
- «I benefici ambientali della carne coltivata in laboratorio sono un imperativo potente per continuare ed espandere la ricerca sulla labricoltura, e in particolare per sviluppare metodi per produrre carne coltivata nel modo più efficiente possibile.»
Il ruolo della modificazione genetica
Nella produzione di carne coltivata non sono richieste tecniche di ingegneria genetica, come inserimento, cancellazione, soppressione, attivazione o mutazione di geni. Pertanto la carne coltivata non sarebbe OGM, ma formata solamente da cellule coltivate artificialmente per la formazione di tessuti.
Nonostante l'uso di ingegneria genetica non sia necessario, molti ricercatori discutono sull'idea di utilizzarla per migliorare qualità e sostenibilità della carne coltivata.L'uso di ingegneria genetica potrebbe inoltre permettere di ottenere un mezzo di coltura vegetale decisamente migliore, evitando l'utilizzo di prodotti animali.
Considerazioni etiche
Il bioeticista australiano Julian Savulescu ha dichiarato:
- «La carne sintetica ferma le crudeltà nei confronti degli animali, è migliore per l'ambiente, può essere più sicura, efficiente e anche più salutare. Abbiamo l'obbligo morale di sostenere questo tipo di ricerca.»
Gruppi che si interessano del benessere degli animali sono generalmente favorevoli alla produzione di carne coltivata, dal momento che non possiede sistema nervoso e pertanto non può sentire dolore. Le legislazioni degli Stati dovrebbero essere modificate ed adattate al nuovo prodotto alimentare.
Infine, la produzione di carne coltivata chiede metodi di produzione sofisticati, l'azienda SuperMeat afferma che la tecnologia capace di creare carne sarà disponibile anche per i supermarket locali, i ristoranti, e addirittura come elettrodomestico a casa propria.
In Italia si è occupato del tema il bioeticista Luca Lo Sapio. In particolare, nel saggio La carne sintetica. Un volano per costruire un nuovo rapporto tra sapiens e gli animali non umani ha messo in evidenza l'impatto positivo che questa nuova tecnologia può avere sugli equilibri della biosfera, sulla salute umana e sul benessere degli animali non umani.
Economia
La produzione di carne in vitro è molto costosa. Nel 2008 occorrevano 1 milione di dollari per una bistecca di 250g, e richiederebbe grandi investimenti per passare ad una produzione su larga scala. Tuttavia lo In vitro meat consortium stima che i miglioramenti delle tecnologie potrebbero portare ad una sensibile riduzioni dei costi, arrivando presto a 3,5 €/Kg.
Nel marzo del 2015, in un'intervista alla ABC australiana, Mark Post dichiarò che il prezzo per l'originale hamburger da 250.000 € ammonta al 2020 a solo 8 euro. Secondo Post la carne coltivata potrebbe diventare competitiva con la carne tradizionale nei prossimi dieci anni.
Giornalisti della trasmissione Patti chiari, della televisione svizzera italiana, sono andati a Singapore per testare i bocconcini di pollo prodotti da Eat Just. Il cuoco responsabile della degustazione ha affermato che il prezzo di vendita di 3 bocconcini di pollo è di 15 franchi svizzeri o più precisamente 23 dollari di Singapore. Un bocconcino di pollo ha un peso indicativo di 17 grammi, quindi circa 300 franchi al kg.
Voci correlate
Altri progetti
Altri progetti
-
 Wikiquote contiene citazioni di o su carne sintetica
Wikiquote contiene citazioni di o su carne sintetica
-
 Wikimedia Commons contiene immagini o altri file su carne sintetica
Wikimedia Commons contiene immagini o altri file su carne sintetica
Collegamenti esterni
- In Vitro Meat Consortium, su invitromeat.org.
- New Harvest, su new-harvest.org.
- Arriva la bistecca sintetica è carissima e insipida ma piace ai vegetariani, su ricerca.repubblica.it.
- Salsicce e hamburger in provetta, le staminali contro la fame nel mondo, su corriere.it.
- PETA Offers $1 Million Reward to First to Make In Vitro Meat, su peta.org.
| Controllo di autorità | J9U (EN, HE) 987010679336005171 |
|---|