
Amsacrina
| Amsacrina | |
|---|---|
 | |
| Nome IUPAC | |
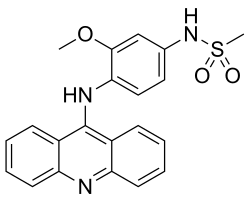
| N-(4-(acridin-9-ilammino)-3-metossifenil)metansulfonammide | |
| Nomi alternativi | |
| m-AMSA | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C21H19N3O3S |
| Massa molecolare (u) | 393,46 |
| Numero CAS | 51264-14-3 |
| Numero EINECS | 257-094-3 |
| Codice ATC | L01XX01 |
| PubChem | 2179 |
| DrugBank | DB00276 |
| SMILES |
COC1=C(C=CC(=C1)NS(=O)(=O)C)NC2=C3C=CC=CC3=NC4=CC=CC=C42 |
| Dati farmacocinetici | |
| Legame proteico | dal 96% al 98% |
| Emivita | 8-9 ore |
| Indicazioni di sicurezza | |
L'amsacrina (o m-AMSA) è un farmaco antineoplastico impiegato nel trattamento di alcune leucemie, in particolare nella leucemia linfoblastica acuta.
Indice
Meccanismo d'azione
È un agente intercalante correlato alle antracicline. Il suo nucleo planare acridinico si intercala tra i solchi della doppia elica del DNA, alterando il rapporto dimensionale tra solco maggiore e minore. Questa alterazione conformazione indotta comporta l'inibizione della trascrizione e della duplicazione del DNA come risultato di una minore affinità nei confronti di DNA polimerasi, RNA polimerasi e fattori di trascrizione.. L'amsacrina mostra anche attività inibitoria intrinseca della topoisomerasi II, simile a quella dell'etoposide. La strutturalmente simile o-AMSA, che differisce per la sola posizione del metossile, in orto al posto che in meta sull'anelloanilinico non ha alcun effetto inibitorio nei confronti delle topoisomerasi, sebbene sia in grado di intercalare il DNA, suggerendo che la sola intercalazione non è sufficiente per creare un complesso covalente DNA-topoisomerasi. Conseguentemente al meccanismo d'azione l'm-AMSA è più attiva sulle cellule in attiva proliferazione, ovvero si comporta da antitumorale ciclo cellulare specifico.
Nonostante la stretta analogia con le antracicline non sempre si verifica resistenza crociata con i farmaci di questa classe. Esercita anche un’azione sulle membrane cellulari modificando la loro funzionalità.
Farmacocinetica
L'amsacrina è scarsamente assorbita dopo somministrazione orale. Se somministrata per via endovenosa, segue una cinetica di secondo ordine con un'emivita totale di 7 ore circa. Viene metabolizzata nel fegato ed eliminata prevalentemente nelle feci (80%).
Tossicità
La dose letale 50 (DL50) nel topo è di 810 mg/m² (maschio) e 729 mg/m² (femmina).
Indicazioni terapeutiche
È indicata nell'induzione e nel mantenimento della remissione in casi di leucemia acuta nell'adulto, in particolare nella leucemia linfoblastica acuta. Non mostra pressoché alcuna attività nei confronti dei tumori solidi.
Effetti collaterali
L'amsacrina causa generalmente un deficit più o meno prolungato e dose-dipendente della funzione ematopoietica del midollo osseo. La massima leucocitopenia si ha dopo circa 12 giorni dall'assunzione del farmaco, ed il recupero avviene dopo circa 25 giorni. Può dare pancitopenia. Può provocare epatotossicità, anche fatale. L'amsacrina è irritante, può causare flebite e necrosi tissutale nel sito d'iniezione per somministrazione di alte dosi per via endovenosa. Altri effetti collaterali sono: stomatite, nausea, vomito e diarrea, convulsioni, alopecia, complicazioni conseguenti alla mielosoppressione (come infezioni ed emorragie), raramente fibrillazione e tachicardia sopraventricolare, specialmente in pazienti con ipokaliemia preesistente.
Controindicazioni e precauzioni d'uso
È controindicata in gravidanza e nei soggetti con ipokaliemia. In corso di trattamento con amsacrina, bisogna effettuare controlli periodici della funzione ematopoietica, della funzionalità epatica e renale.
Bibliografia
- PF. D'Arcy, Reactions and interactions in handling anticancer drugs. (abstract), in Drug Intell Clin Pharm, vol. 17, n. 7-8, giugno 1983, pp. 532-8, PMID 6872848. URL consultato il 22 novembre 2020 (archiviato dall'url originale l'11 aprile 2013).
- Bruce F. Cain, Graham J. Atwell, William A. Denny, Potential antitumor agents. 16. 4'-(Acridin-9-ylamino)methanesulfonanilides, in Journal of Medicinal Chemistry, vol. 18, n. 11, 1975, pp. 1110–1117, DOI:10.1021/jm00245a013. URL consultato il 16 luglio 2012.
- Bruce F. Cain, Graham J. Atwell, William A. Denny, Potential antitumor agents. 23. 4'-(9-Acridinylamino)alkanesulfonanilide congeners bearing hydrophilic functionality, in Journal of Medicinal Chemistry, vol. 20, n. 8, 1977, pp. 987–996, DOI:10.1021/jm00218a001. URL consultato il 16 luglio 2012.
- William A. Denny, Graham J. Atwell, Bruce F. Cain, Potential antitumor agents. 26. Anionic congeners of the 9-anilinoacridines, in Journal of Medicinal Chemistry, vol. 21, n. 1, 1978, pp. 5–10, DOI:10.1021/jm00199a002. URL consultato il 16 luglio 2012.
- DD. Shoemaker, RL. Cysyk; PE. Gormley; JJ. DeSouza; L. Malspeis, Metabolism of 4'-(9-acridinylamino)methanesulfon-m-anisidide by rat liver microsomes. (abstract), in Cancer Res, vol. 44, n. 5, maggio 1984, pp. 1939-45, PMID 6546898. URL consultato il 22 novembre 2020 (archiviato dall'url originale il 24 novembre 2020).
- Daniel M Byrd, Antiviral activities of 4'-(9-acridinylamino)-methanesulfon-m-aniside, in Annals of the New York Academy of Sciences, vol. 284, 1 Third Confere, 1977, pp. 463–471, DOI:10.1111/j.1749-6632.1977.tb21982.x. URL consultato il 16 luglio 2012.
- B.C. Baguley, E-M. Falkenhaug, J.M. Rastrick, J. Marbrook, An assessment of the immunosuppressive activity of the anti-tumour compound 4′-[(9-acridinyl)amino]methanesulphon-m-anisidide (m-AMSA), in European Journal of Cancer (1965), vol. 10, n. 3, 1974, pp. 169–176, DOI:10.1016/0014-2964(74)90150-9. URL consultato il 16 luglio 2012.
- SS. Legha, MJ. Keating; AR. Zander; KB. McCredie; GP. Bodey; EJ. Freireich, 4'-(9-Acridinylamino) methanesulfon-m-anisidide (AMSA): a new drug effective in the treatment of adult acute leukemia. (abstract), in Ann Intern Med, vol. 93, n. 1, luglio 1980, pp. 17-21, PMID 6930826.
Altri progetti
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su amsacrina
Wikimedia Commons contiene immagini o altri file su amsacrina