
Antracene
| Antracene | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| antracene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C14H10 |
| Massa molecolare (u) | 178,23 |
| Aspetto | solido |
| Numero CAS | 120-12-7 |
| Numero EINECS | 204-371-1 |
| PubChem | 8418 |
| SMILES |
C1=CC=C2C=C3C=CC=CC3=CC2=C1 |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | 215 °C (488 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | 315 - 410 |
| Consigli P | 273 - 280 - 302+352 - 332+313 - 501 |
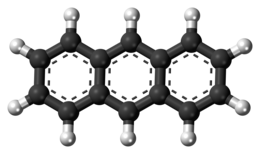
L'antracene è un composto idrocarburico policiclico aromatico (IPA) solido costituito da tre anelli benzenici condensati e possiede struttura lineare.
L'antracene è utilizzato nell'industria dei coloranti per la sintesi del colorante Rosso d'alizarina. Era utilizzato anche come conservante nell'industria del legname, grazie alle sue proprietà insetticide. L'antracene è incolore, ma presenta fluorescenza blu se investito da una fonte di luce ultravioletta.
L'antracene subisce con estrema facilità fotodimerizzazione per irradiazione con UV.
Il dimero è tenuto assieme da due legami covalenti risultanti da una cicloaddizione [4+4]. Il dimero si riconverte in antracene termicamente o per irradiazione UV utilizzando una lunghezza d'onda inferiore ai 300 nm. Le proprietà fotochimiche dell'antracene costituiscono le basi per un suo uso come rivelatore micromolecolare d'ossigeno, in quanto le caratteristiche reazioni fotochimiche a cui va incontro tale molecola sono inibite in assenza di tale gas.
In molte altre reazioni dell'antracene è coinvolto l'anello centrale che è il più reattivo, perché gli elettroni p non sono ugualmente delocalizzati sull'intera struttura, dunque le posizioni preferite per una sostituzione elettrofila sono la 9 e la 10. Le strutture risultanti da una sostituzione 9-10 hanno energia di risonanza superiore a quella posseduta da prodotti risultanti da altre sostituzioni cosa che giustifica la preferenza di sostituzione.
A differenza di altri composti aromatici, l'antracene dà anche reazioni di addizione sull'anello centrale. Il prodotto, infatti, conserva l'aromaticità dei due anelli laterali ed è quindi stabilizzato. Sempre sullo stesso anello avviene facilmente anche l'ossidazione con bicromati, dando antrachinone, C14H8O2 .
Derivati dell'antracene contenenti gruppi ossidrilici, sono l'1-idrossiantracene e il 2-idrossiantracene, omologhi del fenolo e del naftolo. L'idrossiantracene è anche chiamato antrolo o antracenolo. I derivati idrossiantracenici posseggo elevata attività purgante e costituiscono alcuni dei principi attivi contenuti nell'aloe, essi sono dei potenti irritanti della mucosa intestinale.
L'antracene ha trovato ultimamente spazio come semiconduttore organico, è inoltre utilizzato come scintillatore per il rilevamento di radiazioni ionizzanti, elettroni veloci e particelle alfa.
A differenza di altri idrocarburi policiclici aromatici (IPA), l'antracene non è una sostanza cancerogena, ma è stato recentemente inserito dall'Agenzia Europea per le sostanze chimiche (ECHA) tra le sostanze di alta preoccupazione (SVHC). perché persistente, bioaccumulabile e tossico (PBT) per gli organismi acquatici L'antracene, come gli altri IPA, si forma essenzialmente da processi di combustione: l'esposizione dell'uomo avviene principalmente attraverso il fumo di tabacco e l'ingestione di cibo contaminato da prodotti della combustione.
Voci correlate
Altri progetti
Altri progetti
-
 Wikizionario contiene il lemma di dizionario «antracene»
Wikizionario contiene il lemma di dizionario «antracene» -
 Wikimedia Commons contiene immagini o altri file su antracene
Wikimedia Commons contiene immagini o altri file su antracene
Collegamenti esterni
- (EN) Antracene, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- IARC - Monograph 32 (PDF), su monographs.iarc.fr. URL consultato il 17 novembre 2008 (archiviato dall'url originale il 14 novembre 2009).
- National Pollutant Inventory - Polycyclic Aromatic Hydrocarbon Fact Sheet, su npi.gov.au. URL consultato il 18 maggio 2006 (archiviato dall'url originale il 18 maggio 2006).
- NIST Chemistry WebBook Anthracene, su webbook.nist.gov.
- Agenzia Europea per le Sostanze Chimiche - ECHA, su echa.europa.eu. URL consultato il 26 settembre 2011 (archiviato dall'url originale il 26 settembre 2011).
| Controllo di autorità | Thesaurus BNCF 30847 · LCCN (EN) sh85005547 · GND (DE) 4142625-3 · BNF (FR) cb122859484 (data) · J9U (EN, HE) 987007295601505171 |
|---|