
Carbene

Il carbene è una specie chimica metastabile con formula generale R2C:, molto sfruttata in chimica organica e metallorganica a causa della sua reattività. Il capostipite dei carbeni è il metilene :CH2, la cui esistenza è stata dimostrata nel 1959 con l'ausilio della spettroscopia; un altro carbene molto comune è il diclorocarbene :CCl2.
Un carbenoide è una specie, relativamente più stabile, che pur non essendo un carbene vero e proprio possiede caratteristiche e reattività molto simili (ad es. si addizionano agli alcheni nella sintesi di Simmons-Smith). Un semplice carbenoide è I-CH2-ZnI. Nell'ultimo decennio del XX secolo sono stati dimostrati e caratterizzati carbeni stabili.
Indice
Configurazione elettronica
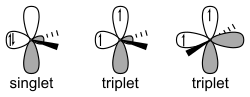
Esistono due differenti tipi di carbeni: il carbene singoletto e il carbene tripletto. Lo stato di tripletto è quello a più bassa energia e quindi più stabile in condizioni normali. Per gli idrocarburi semplici, i carbeni tripletti di solito sono 8 kcal/mole (33 kJ/mole) più stabili dei singoletti. Questa stabilità si deduce in parte dalla regola di Hund della massima molteplicità.
-
- singoletto
- Nella teoria VB, la molecola ha struttura ibrida sp2 ed è planare, cioè possiede due elettroni spin accoppiati ma non condivisi: cioè un orbitale σ e un orbitale p vuoto.
- Reattività simile al carbocatione e al carbanione uniti sullo stesso carbonio, quindi ha carattere anfifilico (nucleofilo ed elettrofilo). Tale carattere può modificarsi, in un senso o nell'altro, dalla natura elettron donatrice o accettrice dei gruppi R1 ed R2, ma persiste comunque.
- Molti sostituenti (R1 ed R2) possono donare una coppia di elettroni stabilizzando lo stato singoletto delocalizzando la coppia in un orbitale p vuoto. Se l'energia del singoletto è sufficientemente ridotta diventerà lo stato fondamentale.
- L'angolo di legame tipico teorico è θ = 100~110°. Per il metilene si osserva sperimentalmente θ = 102°.
-
- tripletto
- Secondo la teoria del legame di valenza (VB) la molecola può invece essere sia planare sp2 che lineare con ibridazione sp: caratteristica comune è la presenza di due elettroni spaiati che condividono gli orbitali p e σ. La maggior parte dei carbeni ha uno stato fondamentale di tripletto non lineare, ad eccezione di quelli con azoto, ossigeno, zolfo e sostituenti degli alogenuri legati al carbonio bivalente.
- Reattività simile a un diradicale.
- La configurazione di spin tripletto genera paramagnetismo che rende possibile applicare la tecnica spettroscopica EPR per specie sufficientemente stabili.
- L'angolo di legame tipico teorico è θ = 130~150°. Con la tecnica EPR si osserva nel metilene tripletto un angolo θ = 125–140°.
Le strategie per stabilizzare i carbeni tripletto possono essere inefficaci. Il carbene chiamato 9-fluorenilidene ha dimostrato essere una miscela di equilibrio di stati singoletto e tripletto con una differenza di energia di circa 1,1 kcal/mole (4,6 kJ/mole).
È, tuttavia, discutibile se la classe dei diaril carbeni come il fluorene sono veri carbeni perché gli elettroni si possono delocalizzare a tal punto da diventare di fatto biradicali. Esperimenti in silico suggeriscono che i carbeni tripletti possono essere termodinamicamente stabilizzati con eteroatomi elettropositivi come nei carbeni silil e sililossi, specialmente i trifluorosilil.
Sintesi di carbeni
Le più comuni sintesi di carbeni implicano processi di fotolisi o eliminazione:
- fotolisi: ad esempio composti come il diazometano CH2N2 producono carbeni, :CH2 in questo caso, eliminando azoto e raggiungendo maggiore stabilità;
- α-eliminazione: utilizzando una base molto forte, come n-butil litio, è possibile ottenere un carbene da un 1,1-dialogeno-alcano R2CX2. Specie con α-idrogeni acidi producono un carbene anche utilizzando una base più blanda come OH-; così, ad esempio, il cloroformio CHCl3 reagisce con soluzione di idrossido di sodio eliminando acido cloridrico e formando il diclorocarbene:CCl2;
- particolari reazioni di decomposizione e riarrangiamento, come il riarrangiamento di Wolff, producono carbeni intermedi.
Reattività

Carbeni singoletto e tripletto mostrano differente reattività chimica.
- Il singoletto dà reazione stereospecifica syn di addizione ad alcheni: un alchene cis produce un cis-ciclopropano sostituito, un alchene trans produce un trans-ciclopropano sostituito.
- Un carbene tripletto è invece assimilabile ad un diradicale e non dà reazioni concertate. Reagendo genera sempre una coppia di isomeri (la reazione non è stereospecifica).
I carbeni reagiscono anche tramite sostituzione elettrofila con composti aromatici il cui anello risulta attivato da un sostituente (es. reazione di Reimer-Tiemann).
I carbeni sono impiegati anche nella sintesi di composti metallorganici con metalli del blocco d della tavola periodica in basso stato di ossidazione. Un esempio è dato dal composto (CO)5Cr=C(NR2)(C6H5).
Applicazioni
Un'applicazione su larga scala dei carbeni è la produzione industriale di tetrafluoroetene, il precursore del teflon. Viene generato tramite l'intermediazione di difluorocarbene:
l'inserimento di carbeni nei legami C–H è stato ampiamente sfruttato, ad es. nella funzionalizzazione superficiale dei materiali polimerici ed elettropolimerizzazione di adesivi.
Le applicazioni ai coloranti tramite la sintesi del 3-aril-3-trifluorometildiazirina, un precursore del carbene che può essere attivato dal calore, dalla luce o dalla tensione elettrica.
Storia
I carbeni erano stati postulati per la prima volta da Eduard Buchner nel 1903 in studi di ciclopropanazione dell'estere detto etildiazoacetato con toluene.
Nel 1912 Hermann Staudinger convertì gli alcheni in ciclopropani con diazometano e CH2 come intermedio. Doering nel 1954 ne dimostrò l'utilità sintetica con studi sul diclorocarbene.
- Libri
Bibliografia
- T. W. Graham Solomons, Chimica organica, 2ª ed., Bologna, Zanichelli, 2001, pp. 330-333, ISBN 88-08-09414-6.
Voci correlate
- Complesso metallo-carbene
- Carbonio atomico un singolo atomo di carbonio con formula :C:, cioè un doppio carbene. Utilizzato per produrre "veri carbeni" in situ.
- Carbene fogliato deriva la sua stabilità dalla vicinanza di un doppio legame, usato per formare sistemi coniugati.
- Carbene affine, composti simili come il nitrene, sililene.
- Carbenio, carbene protonato.
- Polimerizzazione per apertura dell'anello per metatesi
Collegamenti esterni
- (EN) Compendium of Chemical Terminology, 2ed, IUPAC, ("Gold Book") (1997). Versione online: (2006–) "Carbenes".DOI: 10.1351/goldbook.C00806
| Controllo di autorità | GND (DE) 4147281-0 · NDL (EN, JA) 00565058 |
|---|