Ficoeritrina
| Ficoeritrina | |
|---|---|
| Identificatori | |
| Simbolo | Phycoerythr_ab |
| Pfam | PF02972 |
| SCOP | 1qgw |
La ficoeritrina (a volte abbreviata con la sigla PE) è una proteina cromofora di colore rosso, ovvero un pigmento fotosintetico accessorio, appartenente alla famiglia delle ficobiliproteine aventi lo scopo di intercettare la luce; è presente nelle alghe rosse e nelle criptoficee.
Come tutte le ficobiliproteine è composta da una parte proteica legata tramite legame covalente a dei cromofori chiamati ficobiline. Nella famiglia della ficoeritrina le ficobiline più conosciute sono la ficoeritrobilina, il cromoforo tipico accettore della ficoeritrina, e a volte la ficourobilina. Le ficoeritrine sono solitamente composte di monomeri (αβ), organizzati in un trimero a forma di disco (αβ)3 o in un esamero (αβ)6 (il secondo è l'unità funzionale del ficobilisoma). Questi complessi tipici contengono anche un terzo tipo di subunità detta catena γ.
Indice
Ficobilisomi

Le ficobiliproteine fanno parte di un grande complesso proteico con il compito di intercettare la luce chiamato ficobilisoma. Nelle alghe rosse sono ancorati al lato stromale delle membrane del tilacoide nei cloroplasti, mentre nelle criptoficee sono ridotti e sono densamente raggruppati all'interno del lume del tilacoide, presentando molecole di ficoeritrina PE545.
La ficoeritrina è un pigmento accessorio responsabile della fotosintesi. L'energia luminosa è catturata dalla ficoeritrina e successivamente trasferita alla coppia di molecole di clorofilla, che costituisce il centro di reazione, principalmente tramite la ficocianina e l'alloficocianina, altre due ficobiliproteine.
Caratteristiche strutturali
Le ficoeritrine, eccetto la PE545, sono composte da monomeri (αβ) assemblati in esameri discoidali (αβ)6 o in trimeri (αβ)3 che racchiudono un canale centrale. Nei ficobilisomi ogni trimero o esamero contiene almeno una proteina di collegamento situata nel canale centrale. La B-ficoeritrina (B-PE) e la R-ficoeritrina (R-PE) delle alghe rosse hanno oltre alle catene α e β una terza subunità γ che combina la proteina di collegamento e le funzioni di intercettazione della luce poiché porta dei cromofori.

La R-ficoeritrina è prodotta prevalentemente dalle alghe rosse. La proteina è costituita da almeno tre differenti subunità e varia a seconda della specie di alga che la produce. La struttura delle subunità della R-ficoeritrina più comune è (αβ)6γ. La subunità α possiede due ficoeritrobiline (PEB), la subunità β invece ne ha due o tre e possiede inoltre una ficourobilina (PUB), mentre le subunità γ presentano tre PEB e due PUB (è il caso della subunità γ1) o una o due PEB e una sola PUB (come nella subunità γ2). Il peso molecolare della R-ficoeritrina è di 250000 Dalton.
Le strutture cristalline disponibili nel Protein Data Bank contengono in una unità asimmetrica (αβ)2 o (αβγ)2 di diverse ficoeritrine:


| Cromoforo o altra molecola non proteica | Ficoeritrina | Catena | |||
|---|---|---|---|---|---|
| PE545 | B-PE | R-PE | altri tipi | ||
| Biline | 8 | 10 | 10 | 10 | α e β |
| Ficoeritrobilina (PEB) | 6 | 10 | 0 o 8 | 8 | β (PE545) o α e β |
| 15,16-diidrobiliverdina (DBV) | 2 | - | - | - | α (-3 e -2) |
| Ficocianobilina (CYC) | - | - | 8 o 7 o 0 | - | α e β |
| Biliverdina IX alpha (BLA) | - | - | 0 o 1 | - | α |
| Ficourobilina (PUB) | - | - | 2 | 2 | β |
| 5-idrossilisina (LYZ) | 1 o 2 | - | - | - | α (-3 o -3 e -2) |
| N-metil asparagina (MEN) | 2 | 2 | 0 o 2 | 2 | β |
| Ione solfato SO42− (SO4) | - | 5 o 1 | 0 o 2 | - | α o α e β |
| Ione cloruro Cl− (CL) | 1 | - | - | - | β |
| Ione magnesio Mg2+ (MG) | 2 | - | - | - | α-3 e β |
| File del PDB controllati | 1XG0 1XF6 1QGW |
3V57 3V58 |
1EYX 1LIA 1B8D |
2VJH | |
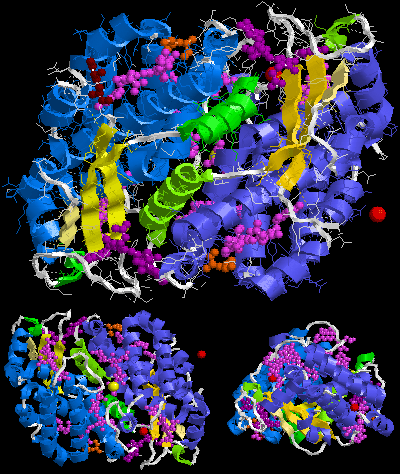
La molecola biologica della ficoeritrina 545 è di tipo (αβ)2 o piuttosto (α3β)(α2β). I numeri 2 e 3 dopo le lettere α nella seconda formula sono in questo caso parte del nome della catena, non il loro computo. Il nome corrispondente delle criptoficee della catena α3 è catena α1.
Il più grande assemblaggio di molecole della B-ficoeritrina (B-PE) è il trimero (αβ)3. Tuttavia alcune preparazioni effettuate con alghe rosse danno anche l'esamero (αβ)6. Nel caso della R-ficoeritrina la molecola biologica più grande è (αβγ)6, (αβγ)3(αβ)3 o (αβ)6 a seconda della pubblicazione, per altri tipi di ficoeritrina è invece (αβ)6. Queste catene γ sono molto brevi e consistono solamente di tre o sei aminoacidi riconoscibili , mentre la catena γ di collegamento è più lunga (ad esempio la catena γ33 dell'alga rossa Aglaothamnion neglectum misura 277 aminoacidi ed è lunga 33 kDa). Questo perché la densità elettronica del gamma-polipeptide è in gran parte mediata dalla sua triplice simmetria cristallografica e solo pochi aminoacidi possono essere modellati.
Nel caso di (αβγ)6, (αβ)6 o (αβγ)3(αβ)3 i valori della tabella dovrebbero essere moltiplicati per tre, (αβ)3 contiene numeri intermedi di molecole non proteiche.
Nella ficoeritrina PE545 una catena α (-2 or -3) lega una molecola di bilina, in altri casi ne lega due. La catena β si lega sempre a tre molecole. La breve catena γ non si lega a nessuna molecola.
Due molecole di N-metil asparagina sono legate alla catena β, una 5-idrossilisina ad una catena α (-3 o -2), uno ione Mg2+ ad α-3 e β, uno ione Cl− a β, e una o due molecole di ione SO42− ad α o β.


Caratteristiche spettrali

I picchi di assorbimento nello spettro della luce visibile sono misurati a 495 e 545/566 nm, a seconda del legame dei cromofori e dell'organismo considerato. Vi è un forte picco di emissione a 575 ± 10 nm (ciò significa che la ficoeritrina assorbe la luce leggermente blu-verde e giallastra ed emette luce di colore giallo-arancio).
| Proprietà | Valore |
|---|---|
| Massimo di assorbimento | 565 nm |
| Picco d'assorbimento addizionale | 498 nm |
| Massimo di emissione | 573 nm |
| Coefficiente di estinzione (ε) | 1.96 x 106 M−1cm−1 |
| Resa quantica (QY) | 0.84 |
| Luminosità (ε x QY) | 1.65 x 106 M−1cm−1 |
Le biline PEB e DBV presenti nella ficoeritrina PE545 assorbono anche la luce della regione spettrale del verde, con massimi rispettivamente a 545 e 569 nm. Il massimo di emissione fluorescente è a 580 nm.
Varianti della R-ficoeritrina

La ficoeritrina si trova in una certa varietà di specie algali, pertanto possono esservi variazioni nell'efficienza dell'assorbanza e dell'emissione di luce richiesta per l'agevolazione della fotosintesi. Questo potrebbe essere un risultato della profondità nella colonna d'acqua a cui una specifica alga risiede e di un conseguente bisogno di una maggiore o minore efficienza dei pigmenti accessori.
Con i progressi nell'imaging nella tecnologia di rilevazione che riescono a evitare un fotobleaching troppo rapido i fluorocromi proteici sono diventati un vitale e potente strumento per i ricercatori in campi come la microscopia, l'analisi dei microarray e il Western blot. Alla luce di ciò potrebbe essere benefico per i ricercatori vagliare queste R-ficoeritrine variabili per determinare quale tra esse sia la più appropriata per la loro particolare applicazione. Persino un piccolo incremento nell'efficienza della fluorescenza potrebbe ridurre il rumore di fondo e il tasso di risultati falsi negativi.
Applicazioni pratiche
La R-ficoeritrina è utile in laboratorio come indicatore fluorescente per la presenza di cianobatteri e per l'etichettatura degli anticorpi, spesso per la citometria a flusso. Il suo impiego è limitato nella microscopia a immunofluorescenza a causa delle sue caratteristiche di spiccato fotobleaching. Esistono anche altri tipi di ficoeritrine, come la B-ficoeritrina, che hanno proprietà spettrali leggermente differenti. La B-ficoeritrina assorbe fortemente la luce intorno ai 545 nm (regione del verde-giallastro) ed emette fortemente a 572 nm (giallo) e potrebbe essere più adatta per certi strumenti. Tuttavia, la R-ficoeritrina è molto più comunemente disponibile come coniugato degli anticorpi.
La R-ficoeritrina e la B-ficoeritrina sono tra i coloranti fluorescenti più luminosi mai identificati.
Collegamenti esterni
- (EN) Phycoerythrin, in Medical Subject Headings (MeSH), National Library of Medicine, 2009.
