
Formaldeide
| Formaldeide | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| formaldeide (preferito) | |
| Nomi alternativi | |
| metanale (sistematico) aldeide fòrmica | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CH2O |
| Massa molecolare (u) | 30,03 |
| Aspetto | gas incolore |
| Numero CAS | 50-00-0 |
| Numero EINECS | 200-001-8 |
| PubChem | 712 |
| DrugBank | DB03843 |
| SMILES |
C=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,13 (a −19 °C) |
| Temperatura di fusione | −116,9 °C (156,2 K) |
| Temperatura di ebollizione | −19,0 °C (254,1 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −108,6 |
| ΔfG0 (kJ·mol−1) | −102,5 |
| S0m(J·K−1mol−1) | 218,8 |
| C0p,m(J·K−1mol−1) | 35,4 |
| Indicazioni di sicurezza | |
| Punto di fiamma | −53 °C (220 K) |
| Limiti di esplosione | 7 - 73% vol. |
| Temperatura di autoignizione | 430 °C (703 K) |
| Simboli di rischio chimico | |
    
| |
| pericolo | |
| Frasi H | 350 - 341 - 301 - 311 - 331 - 314 - 317 |
| Consigli P | 301+310 - 303+361+353 - 305+351+338 - 320 - 361 - 405 - 501 |
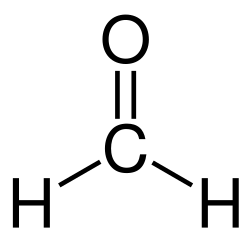
La formaldeide (o aldeide fòrmica, nome sistematico: metanale) è la più semplice delle aldeidi. La sua formula chimica è CH2O, o anche H2C=O.
A temperatura ambiente è un gas incolore, infiammabile, dal caratteristico odore pungente e fortemente irritante, solubilissimo in acqua (~400 g/L). Il suo monomero idrato, erroneamente considerato una sua soluzione acquosa al 37%, è commercialmente noto anche con il nome di formalina o formolo.
Indice
Caratteristiche
La sua molecola è planare, simmetria C2v,ed è notevolmente polare, μ = 2,34 D, più di H2O (1,86 D); l'atomo di carbonio ha ibridazione sp2 ed è al centro di un triangolo non esattamente equilatero, ai cui vertici si trovano i due atomi di idrogeno e quello di ossigeno.
Da indagini spettroscopiche rotazionali (microonde) risulta che la lunghezza dei legami C–H è di 111,6 pm, quella del legame C–O di 120,78 pm e che l'angolo HCO è di 121,8° (da cui segue che l'angolo HCH è di 119,1°). Quest'ultimo è un valore lievemente minore dell'angolo ideale (120°) per l'ibridazione sp2, ma è in accordo qualitativo con la previsione della teoria VSEPR, per la quale un doppio legame (qui C=O) richiede più spazio angolare rispetto a un legame singolo; fenomeni analoghi si hanno anche, ad esempio, per l'acetone, l'etene e il fosgene.

Gassosa a temperatura ambiente, si trova commercialmente in due forme: come formalina, una cosiddetta soluzione acquosa al 37%, o come paraformaldeide, cioè una miscela di prodotti di polimerizzazione della formaldeide, prevalentemente poliossimetileni con grado di polimerizzazione da 8 a 100 e 1,3,5-triossano, molecola eterociclica formata dall'unione di tre molecole di formaldeide. La ciclizzazione, favorita da un ambiente acido, è una reazione reversibile. La paraformaldeide può essere riconvertita in glicole metilenico.
In soluzione acquosa, la formaldeide è in equilibrio con la sua forma idrata, il metandiolo [CH2(OH)2 CAS. 463-57-0 EINECS 207-339-5]. Tale equilibrio a temperatura ambiente è quasi completamente spostato a destra (K > 1000); pertanto una "soluzione acquosa di formaldeide" è di fatto una soluzione acquosa di metandiolo.

Le sue soluzioni acquose sono incolori e posseggono un odore caratteristico. La formaldeide presenta il tipico comportamento chimico delle aldeidi, con la differenza di possedere una maggiore reattività. La formaldeide è un forte elettrofilo ed in quanto tale può dare reazione di sostituzione con i composti aromatici e di addizione agli alcheni.
In presenza di basi, subisce la reazione di Cannizzaro (vedi alcoli) trasformandosi in acido formico e metanolo.
La reazione di Cannizzaro è un esempio di disproporzionamento (o dismutazione), ossia una reazione in cui parte di un composto subisce un'ossidazione mentre un'altra parte subisce una riduzione.
La formaldeide in soluzione acquosa reagisce facilmente con l'ossigeno dell'aria, che la ossida ad acido formico.
Chimica ionica in fase gassosa
La molecola H2CO ha un'energia di ionizzazione pari a 10,88 eV, un po' più alta di quella dell'acetaldeide CH3-CHO (10,23 eV) e significativamente maggiore dell'acetone (CH3)2CO (9,70 eV).
L'affinità elettronica della formaldeide porta a uno ione radicalico distonico non planare e risulta sperimentalmente negativa (-0,65±0,05 eV, valore adiabatico).
L'affinità protonica della formaldeide, che è una misura della sua basicità intrinseca, è pari a 712,9 kJ/mol:
- H2C=O (g) + H+(g) → [ H2C=O+–H ←→ H2C+–O–H ] (g)
Questo valore dell'affinità protonica è ben maggiore di quello dell'acqua (691 kJ/mol), che è meno basica, ma inferiore a quello dell'acetaldeide (768,5 kJ/mol) e ancor più rispetto a quello dell'acetone, (812 kJ/mol), entrambi essendo quindi più basici della formaldeide.
Come fa il protone H+, anche lo ione Li+ può legarsi alla formaldeide, ma l'energia liberata è molto minore, 151 kJ/mol e così pure con lo ione Al+ (115 kJ/mol) e Fe+ (138 kJ/mol).
Produzione
Sintesi di laboratorio
La formaldeide fu individuata per la prima volta nel 1859 dal chimico russo Aleksandr Butlerov. Nel suo articolo, Butlerov si riferiva alla formaldeide come "diossimetilene" (o biossido di metilene) perché la sua formula empirica non era corretta (C4H4O4). Fu definitivamente identificata solo da August Wilhelm von Hofmann, che per primo annunciò la produzione di formaldeide facendo passare il vapore di metanolo nell'aria su un filo di platino caldo. Con modifiche, il metodo di Hoffmann rimane la base dell'attuale percorso industriale.
Le vie di soluzione alla formaldeide comportano anche l'ossidazione del metanolo o dello ioduro di metile.
Sintesi industriale
La formaldeide è prodotta industrialmente dall'ossidazione catalitica del metanolo. I catalizzatori più comuni sono l'argento metallico o una miscela di un ossido di ferro e ossidi di molibdeno o vanadio. Nel processo Formox comunemente usato, il metanolo e l'ossigeno reagiscono a 250-400 °C in presenza di ossido di ferro in combinazione con molibdeno e/o vanadio per produrre formaldeide:
Il catalizzatore a base d'argento normalmente opera a una temperatura più alta, circa 650 °C. Due reazioni chimiche su di esso producono simultaneamente formaldeide: quella mostrata sopra e la reazione di deidrogenazione:
In linea di principio, la formaldeide potrebbe essere generata dall'ossidazione del metano, ma questa via non è praticabile industrialmente perché il metanolo è più facilmente ossidabile del metano.
Utilizzi
La formaldeide è un importante intermedio, utilizzato nella produzione di composti e materiali più complessi. In ordine approssimativo di consumo decrescente, i prodotti generati a partire dalla formaldeide includono la resina urea formaldeide, la resina melamminica, le resine fenoliche, il poliossimetilene, l'1,4-butandiolo e il difenilmetano diisocianato. L'industria tessile utilizza resine a base di formaldeide nel finissaggio per rendere i tessuti resistenti alle pieghe.
In particolare, se trattata con fenolo, urea o melamina, la formaldeide produce, rispettivamente, resina fenolo-formaldeide (un polimero duro e termoindurente), resina urea-formaldeide e resina melamminica. Questi polimeri sono adesivi permanenti utilizzati nel compensato e nella moquette, oltre che utilizzati per produrre schiume isolanti, o colati in prodotti stampati. La produzione di resine rappresenta più della metà del consumo di formaldeide.
La formaldeide è anche un precursore di alcoli polifunzionali come il pentaeritritolo, che viene utilizzato per produrre vernici ed esplosivi. Altri derivati della formaldeide includono metilene difenil diisocianato, un componente importante nelle vernici e nelle schiume poliuretaniche, e l'esammina, che viene utilizzata nelle resine fenolo-formaldeide e nell'esplosivo RDX.
Usi quantitativamente meno significativi sfruttano le proprietà battericide della formaldeide; per questo motivo, soluzioni acquose che la contengono trovano largo impiego come disinfettanti per uso domestico; nella produzione di tessuti a livello industriale viene utilizzata come battericida. Soluzioni di formaldeide vengono anche utilizzate per conservare campioni di materiale biologico. Trova del resto vasto impiego anche nelle tecniche di imbalsamazione.
Viene anche utilizzata in soluzione acquosa (formalina) per la produzione di vaccini, sia per produrre anatossine (o tossoidi), cioè tossine che perdono la tossicità ma mantengono la immunogenicità, a partire da tossine batteriche, sia per produrre vaccini basati su microrganismi uccisi. La maggior parte della formaldeide prodotta è destinata però alla produzione di polimeri e di altri composti chimici.
Tra gli additivi alimentari è identificata dalla sigla E 240, ed è usata come conservante. Difatti è presente nel fumo di legno ed è, insieme ai polifenoli, responsabile della conservazione dei prodotti alimentari affumicati. La formaldeide, insieme all'urea, è impiegata come vernice collante di pannelli in legno di truciolato, nobilitato o Medium-density fibreboard (MDF); è contenuta, inoltre, nei pannelli fonoassorbenti dei controsoffitti e nelle pareti divisorie degli uffici open space. Negli anni tende a volatilizzarsi nell'ambiente circostante. Viene utilizzata per la produzione di isoprenolo. Nella tintura tessile è usata nell'applicazione con i naftoli per dare maggiore stabilità alle soluzioni naftoliche e nel trattamento successivo di alcune tinture ottenute con coloranti diretti con lo scopo di migliorarne la solidità all'acqua ed ai lavaggi in generale.
Effetti sulla salute umana
Dato il largo impiego di resine derivate dalla formaldeide nelle produzioni di manufatti, rivestimenti e schiume isolanti, considerato che queste tendono a rilasciare nel tempo molecole di formaldeide nell'ambiente, la formaldeide è uno dei più diffusi inquinanti di interni. A concentrazioni nell'aria superiori a 0,1 ppm può irritare per inalazione le mucose e gli occhi. L'ingestione o l'esposizione a quantità consistenti sono potenzialmente letali. La cancerogenicità è stata accertata sui roditori, dove la formaldeide provoca un tasso di incidenza di cancro al naso ed alla gola superiori al normale; la formaldeide è in grado di interferire con i legami tra DNA e proteine.
L'Associazione Internazionale per la Ricerca sul Cancro (AIRC) sin dal 2004 ha inserito la formaldeide nell'elenco delle sostanze considerate con certezza cancerogene per la specie umana. Va considerato che le concentrazioni di formaldeide presenti normalmente all'interno degli edifici sono generalmente basse, mentre vanno accuratamente valutati i rischi per gli addetti alle lavorazioni industriali che impiegano formaldeide.
L'Organizzazione Mondiale della Sanità ha indicato, come limite massimo di concentrazione accettabile di formaldeide in casa, 100 microgrammi / metrocubo (pari a 0,1 parti per milione - ppm). Fino al momento in cui il prodotto è stato bandito, era uno degli ingredienti delle pastiglie Formitrol per il mal di gola.
Dal 1º gennaio 2016, la formaldeide è passata dalla classificazione di "sospettato di provocare il cancro" a "può provocare il cancro" (Regolamento (UE) N. 605/2014).
Bibliografia
- (EN) Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Industrial organic chemistry, 4ª ed., Wiley-VCH, 2003, pp. 37-42, ISBN 3-527-30578-5.
Voci correlate
Altri progetti
Altri progetti
-
 Wikizionario contiene il lemma di dizionario «formaldeide»
Wikizionario contiene il lemma di dizionario «formaldeide» -
 Wikimedia Commons contiene immagini o altri file su formaldeide
Wikimedia Commons contiene immagini o altri file su formaldeide
Collegamenti esterni
- formalina, su sapere.it, De Agostini.
- (EN) Formaldeide, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) ChemSub Online: Formaldeide, su chemsub.online.fr.
- Formaldeide, sulla Matrice di esposizione a cancerogeni - MATline, su dors.it.
| Controllo di autorità | Thesaurus BNCF 21880 · LCCN (EN) sh85050805 · GND (DE) 4017845-6 · BNF (FR) cb12062041r (data) · J9U (EN, HE) 987007545720905171 · NDL (EN, JA) 00563450 |
|---|

