Ibritumomab tiuxetan
| Ibritumomab tiuxetan | |
|---|---|
 | |
| Caratteristiche generali | |
| Massa molecolare (u) | g·mol-1 |
| Numero CAS | 174722-31-7 |
| Codice ATC | V10XX02 |
| DrugBank | DB00078 |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | ° C |
| Temperatura di ebollizione | ° C |
| Dati farmacologici | |
| Modalità di somministrazione |
Endovena |
| Indicazioni di sicurezza | |
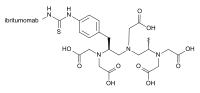
L'ibritumomab tiuxetano, in commercio con il nome di Zevalin, è un anticorpo monoclonale per il trattamento radioimmunoterapico di alcune forme di cellule B di linfoma non Hodgkin, che è un disordine linfoproliferativo del sistema linfatico. Il farmaco utilizza l'anticorpo IgG1 monoclonale di topo: ibritumomab in collaborazione con il chelante tiuxetano, a cui viene aggiunto un isotopo radioattivo a base di ittrio-90 o indio-111.
L'ibritumomab è una versione modificata del DTPA carbonio (Acido pentenico o Acido Dietilene triamine pentaacetico (DTPA)) nella cui struttura chimica è contenuto un gruppo isotiocianatobenzilico e un gruppo metilico.
Indice
Storia
Sviluppato dalla IDEC Pharmaceuticals, ora diventata Biogen Idec, l'anticorpo tiuxetano è stato il primo farmaco radioimmunoterapico approvato dalla Food and Drug Administration (FDA) nel 2002 per il trattamento dei tumori. È stato approvato per il trattamento di pazienti con linfoma non Hodgkin (NHL) in recidiva, inclusi i pazienti con LNH follicolare refrattario al rituximab.
Nel dicembre 2007, la Cell Therapeutics Inc ha acquisito per gli USA i diritti di vendita, commercializzazione e distribuzione di questo anticorpo radioimmunoterapico dalla Biogen per circa 30 milioni di dollari. Al di fuori degli Stati Uniti, è la Bayer Schering Pharma che possiede i diritti di commercializzazione del farmaco.
Nel marzo 2009, Spectrum Pharmaceuticals ha acquisito i diritti per commercializzare lo Zevalin negli Stati Uniti; ed ora la Spectrum Pharmaceuticals è responsabile di tutte le attività relative a Zevalin negli Stati Uniti.
Nel settembre 2009, l'anticorpo tiuxetano ha ottenuto l'approvazione dalla FDA per l'indicazione più importante: trattamento dei pazienti con linfoma follicolare non-Hodgkin (NHL) non precedentemente trattati, che raggiungono una risposta parziale o completa alla chemioterapia di prima linea.
Ibritumomab è sotto copertura brevettuale, ed è attualmente il farmaco più costoso per singola dose disponibile negli USA (24000 $). Va però precisato che la terapia con il farmaco ha un equivalente farmacoeconomico vantaggioso per la riduzione dei tempi di trattamento.
Farmacologia
L'anticorpo si lega all'antigene CD20 che si trova sulla superficie delle cellule B sane e tumorali ma non sui precursori di queste. L'isotopo radioattivo legato all'anticorpo uccide le cellule cui si lega e quelle circostanti. Inoltre, lo stesso anticorpo può innescare la morte cellulare cellulo-mediata citotossicca anticorpo-dipendente (ADCC), la citotossicità complemento-dipendente (CDC), e l'apoptosi. Tutte insieme queste azioni eliminano le cellule B dall'organismo affetto da linfoma non Hodgkin permettendo ad una nuova popolazione di cellule sane B di svilupparsi partendo dalle cellule staminali linfoidi.
Bibliografia
- Frank Ashall, Le grandi scoperte scientifiche, Armando Editore, 1999, pp. 245–, ISBN 978-88-7144-949-4.
- Abul K. Abbas, Andrew H. Lichtman e Shiv Pillai, Immunologia cellulare e molecolare, Elsevier srl, 2010, pp. 79–, ISBN 978-88-214-3176-0.
- accessdate Abul K. Abbas e Andrew H. Lichtman, Le basi dell'immunologia, Elsevier srl, 2006, pp. 70–, ISBN 978-88-85675-85-8.
- accessdate Humphrey P. Rang, M. Maureen Dale e James M. Ritter, Farmacologia, Elsevier srl, 2008, pp. 778–, ISBN 978-88-214-3023-7.
- Enzo Fagiolo, Immunoematologia, Mediserve s.r.l., 2007, pp. 16–, ISBN 978-88-8204-135-9.
- Paolo Larizza, Trattato di medicina interna, PICCIN, 2005, pp. 909–, ISBN 978-88-299-1721-1.
- Angelo Sghirlanzoni, Terapia Delle Malattie Neurologiche, Springer, 3 aprile 2010, pp. 113–, ISBN 978-88-470-1119-9.
- Thomas C. King, Patologia, Elsevier srl, 2008, pp. 156–, ISBN 978-88-214-3019-0.
- (EN) whqlibdoc.who.int (archiviato dall'url originale il 16 ottobre 2009).
- (EN) Marie A. Simmons, Monoclonal antibodies: new research, Nova Publishers, 2005, ISBN 978-1-59454-247-3.
- (EN) Zhiqiang An, Therapeutic Monoclonal Antibodies: From Bench to Clinic, John Wiley and Sons, 8 settembre 2009, ISBN 978-0-470-11791-0.
- (EN) James W. Goding, Monoclonal antibodies: principles and practice : production and application of monoclonal antibodies in cell biology, biochemistry and immunology, Academic Press, 1996, ISBN 978-0-12-287023-1.
- (EN) Steve Shire, Current Trends in Monoclonal Antibody Development and Manufacturing, Springer, aprile 2009, ISBN 978-0-387-76642-3.
Ibritumomab tiuxetan
- (EN) Gopal B. Saha, Fundamentals of Nuclear Pharmacy, Springer, 14 novembre 2010, pp. 328–, ISBN 978-1-4419-5859-4.
- (EN) Connie Henke Yarbro, Debra Wujcik e Barbara Holmes Gobel, Cancer Nursing: Principles and Practice, Jones & Bartlett Learning, 21 aprile 2010, pp. 794–, ISBN 978-0-7637-6357-2.
- (EN) Gail M. Wilkes, Gail M Wilkes, R.N., M.S., Margaret Barton-Burke, Margaret Barton-Burke, R.N., PH.D., Oncology Nursing Drug Handbook 2011, Jones & Bartlett Publishers, 14 dicembre 2010, pp. 575–, ISBN 978-1-4496-0013-6.
- (EN) Tod W. Speer, Targeted Radionuclide Therapy, Lippincott Williams & Wilkins, 15 novembre 2010, pp. 1–, ISBN 978-0-7817-9693-4.
- (EN) Michael R. Bishop, Hematopoietic Stem Cell Transplantation, Springer, 2009, pp. 305–, ISBN 978-0-387-78579-0.
Collegamenti esterni
- www.zevalin.com, su zevalin.com.
- www.spectrumpharm.com, su spectrumpharm.com.
