Metadone
| Metadone | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| (RS 6 dimetilammino-4,4 difenil-3 eptanone) | |
| Nomi alternativi | |
| (+/-)-Methadone; (+/-)-Methadone hydrochloride; dl-Methadone; DL-Methadone hydrochloride; Methadon; Methadone HCL; Methadone hydrochloride; Phenadone hydrochloride | |
| Caratteristiche generali | |
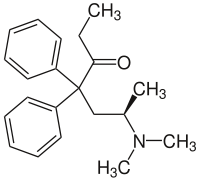
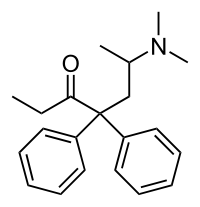
| Formula bruta o molecolare | C21H27NO |
| Massa molecolare (u) | 309.445 g/mol |
| Numero CAS | 76-99-3 |
| Numero EINECS | 200-996-9 |
| Codice ATC | N02AC52 |
| PubChem | 4095 |
| DrugBank | DB00333 |
| SMILES |
CCC(=O)C(CC(C)N(C)C)(C1=CC=CC=C1)C1=CC=CC=C1 |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida (pKa) a 25 °C K | 8.94 |
| Solubilità in acqua | in acqua 48.5 mg/L (25 °C) |
| Coefficiente di ripartizione 1-ottanolo/acqua | 3.93 |
| Temperatura di fusione | 235.0 °C |
| Dati farmacologici | |
| Categoria farmacoterapeutica | Narcotico; Analgesico; Agonista oppioidi; Antitussivo; |
| Modalità di somministrazione |
orale (NB: In Italia), intravenosa, insufflazione, sublinguale, rectale. |
| Dati farmacocinetici | |
| Biodisponibilità | 40-90% (orale) |
| Legame proteico | 85-90% all'α1-glicoproteina acida |
| Metabolismo | epatico |
| Emivita | 24 - 36 ore |
| Escrezione | urinaria e fecale |
| Indicazioni di sicurezza | |

Il metadone (noto con diversi nomi, tra cui: Polamidon, Eptadone, Dolophine, ecc.) è un oppioide sintetico, usato in medicina come analgesico nelle cure palliative e utilizzato per ridurre l'assuefazione nella terapia sostitutiva della dipendenza da stupefacenti.
È stato sintetizzato in Germania nel 1937; pur chimicamente differente dalla morfina o dall'eroina, agisce come queste primariamente sul μ-recettore degli oppioidi (agonista puro) con effetti clinici simili.
Il metadone è utilizzato utilmente nel controllo del dolore cronico per la sua lunga durata d'azione ed il basso costo. Inoltre, da molti anni, viene usato nel trattamento della dipendenza da oppiacei, pur essendo noto il suo potenziale rischio di dipendenza e tolleranza farmacologica. La sindrome di astinenza da metadone, pur qualitativamente simile a quella della morfina, ha un esordio più lento ma più prolungato e con una sintomatologia simile.
Nel 2005 l'Organizzazione mondiale della sanità (WHO) lo ha incluso nella lista dei farmaci essenziali; ciò, anche, per la ben documentata efficacia nella terapia delle tossicodipendenze.
Indice
Storia
Nel 1932 fu scoperta la petidina (chiamata Pethidine, Dolantin, Demerol, Dolosal. etc.), da parte di O. Eisleb e O. Schaumann, dopo decenni di ricerca su composti di origine vegetale petidino-simili, grazie anche ad una dose di fortuna e sagacia farmacologica. La novità della scoperta sta nel fatto che la petidina fu la prima molecola analgesica chimicamente non correlata alla struttura della morfina.
Successivamente Max Bockmühl e Gustav Ehrhart lavorarono su composti con una struttura simile alla petidina (Dolantin) nella speranza di trovare una sostanza che fosse solubile in acqua ed utilizzabile come ipnotico e che fosse anche in grado di rallentare il transito gastrointestinale per facilitare la chirurgia. I due dipendenti della IG Farbenindustrie a Höchst-Am-Main, in Germania, sviluppano così il metadone, che fu poi brevettato l'11 settembre 1941.
La sostanza fu usata e preferita alla petidina, come sostituto della morfina, solo durante la II guerra mondiale quando era divenuta difficile trovare la petidina in Germania. Per la mancanza di correlazione chimica con la morfina e per gli effetti collaterali diversi, non venne riconosciuta come un analgesico; si dovettero aspettare le ricerche successive alla II guerra mondiale per comprendere il potenziale terapeutico di questa sostanza.
Il nome è erroneamente ritenuto tragga origine da "adolfina" in onore di Adolf Hitler, ma ciò è solo una leggenda metropolitana. Il nome Dolophine, infatti, deriva dalla unione delle parole francesi Dolor e fin, esso è sempre stato un marchio registrato di Eli Lilly; è ancor oggi usato con lo stesso nome.
Dopo la guerra il brevetto del farmaco fu espropriato come risarcimento per i danni di guerra e i documenti vennero esportati negli Stati Uniti. Nel 1947 la società farmaceutica statunitense Eli Lilly con il nome di Dolophine lo introdusse nel mercato USA e successivamente in altri paesi nel mondo. In Germania il farmaco fu reintrodotto nel 1949 con il nome di Polamidon, dalla Hoechst AG, erede della IG Farben, oggi confluita in Sanofi Aventis.
Dal 1960 il metadone negli USA è usato come sostanza utile nello svezzamento farmacologico definitivo della dipendenza da oppioidi (eroina), partendo dal presupposto scientifico che la dipendenza agli oppioidi va trattata alla stregua di una comune malattia metabolica. Questi programmi successivamente sono stati variamente ripresi nel mondo.
In Italia sin dall'agosto del 1980 viene utilizzato come sostituto dell'eroina contro i sintomi somatici dovuti all'astinenza durante lo svezzamento da eroina ed oppioidi. Significativamente, inoltre, da alcuni decenni anche in Italia la sostanza farmacologica trova un utile impiego nella terapie del dolore oncologico o cronico incoercibile, in alternativa alla morfina, ossicodone,idromorfone e fentanyl.
Caratteristiche strutturali e fisiche
Sintesi del composto

Il metadone è prodotto interamente per via sintetica, a differenza dell'eroina che è ottenuta da sostanze semi-naturali prodotte sinteticamente dagli alcaloidi dell'oppio, come la morfina. Chimicamente e strutturalmente si differenzia nettamente dalla morfina e dalla eroina. Il processo di sintesi chimica del metadone racemico è abbastanza semplice, si ottiene a partire dal nitrile con la sintesi di Kolbe e con il difenilacetonitrile che è facilmente disponibile. Si può ottenere la formazione di un racemo L-(+) con l'acido tartarico.
Chimicamente correlate al metadone vi sono le seguenti molecole:
- Metadone (4,4-diphenyl-6-dimethylaminoheptanone-3,6- dimethylamino-4,4-diphenyl-3-heptanone);
- Isometadone (4,4-diphenyl-5-methyl-dimethylaminohexa-none-3, 6-dimethylamino-5-methyl-4,4-diphenyl-3-hexanone);
- Alfa-metadol (α-4,4-diphenyl-6-dimethylaminoheptanol- 3, α-6-dimethylamino-4,4-diphenyl-3-heptanol);
- Beta-metadol (β-4,4-diphenyl-6-dimethylamino-3-heptanol, β-6-dimethylamino-4,4-diphenyl-3-heptanol);
- Alfa-acetilmetadol (α-4,4-diphenyl-6-dimethylamino-3-acetoxyheptane, α-6-dimethylamino-4,4-diphenyl-3-acetoxyheptane);
- Beta-acetilmetadol (β-4,4-diphenyl-4-dimethylamino-3-acetoxyheptane, β 6-dimethylamino-4,4-diphenyl-3-acetoxyheptane);
- Fenadoxone (4,4-diphenyl-6-morpholinoheptanone-3, 6- morpholino-4,4-diphenyl-3-heptanone);
- 4,4-Difenil-6-dimetilamino-3-exanone;
- 4-Morfolino-2,2-difenil. etil butirato (etil-2,2-difenil-4-morfolinobutirato);
- 4-Dimetilamino-l,2-difenil-3-metil-2-propionossibutano;
- 4,4-Difenil-6-piperidino-3-eptanone (6-piperidino-4,4- difenileptan-3-one).
Reattività e caratteristiche chimiche
Si presenta in forma di cristalli incolori e inodori o sotto forma di polvere bianca cristallina. Solubile in acqua, facilmente solubile in alcool e in cloroformio, praticamente insolubile in etere e in glicerolo. Il pH di una soluzione all'1% in acqua è compreso tra 4,5 e 6,5. Va conservato in contenitori ermeticamente chiusi ad una temperatura di 25 °C, le escursioni consentite vanno da 15 gradi a 30 °C. Va protetto dalla luce.
Il metadone è una sostanza chirale, pertanto, si presenta come una miscela racemica di due molecole speculari (enantiomeri) in rapporto reciproco di 1:1, rispettivamente la forma levogira di metadone (L)-metadone e la forma destrogira (D)-metadone (in senso orario). La forma destrogira possiede le potenti proprietà antitosse, ma è privo quasi del tutto di proprietà analgesiche; ne consegue che il L-Polamidon (levometadone) è a parità di dose circa due volte più efficace come analgesico, della forma racemica di metadone.
L'enantiomero puro ha un punto di ebollizione a 100 °C; la miscela racemica (eutettica) si scioglie prima con un punto di fusione di 77 °C. Gli enantiomeri puri come il metadone cloridrato hanno un punto di ebollizione a 248 °C; mentre nel caso della miscela di enantiomeri 1:1, il punto di fusione è 237 °C.
Incompatibilità chimica
L'iniezione di metadone cloridrato è stata segnalata essere fisicamente e/o chimicamente incompatibile con soluzioni contenenti: aminofillina, cloruro di ammonio, sodio amobarbital, sodio clorotiazide, sodio fenitoina, eparina sodica, meticillina sodica, sodio nitrofurantoina, sodio pentobarbital, fenobarbital sodico, bicarbonato di sodio e sodio tiopentale.
Farmacocinetica

Il metadone cloridrato è immediatamente assorbito nel tratto gastrointestinale o dopo un'iniezione sottocutanea o intramuscolare. È ampiamente distribuito nei tessuti, si diffonde attraverso la placenta, ed è distribuito nel latte materno. La percentuale di legame con le proteine plasmatiche è elevata. Viene metabolizzato a livello epatico, principalmente con una N-demetilazione e ciclizzazione, e i metaboliti sono escreti nella bile e nelle urine. Il metabolismo è principalmente catalizzato dal CYP3A4, benché altri isoenzimi del citocromo P450 anche possono avere un ruolo. Ha una lunga emivita ed è soggetto ad accumulo.
La farmacocinetica del metadone è particolare per il fatto di avere una lunga emivita di eliminazione, con conseguente accumulo a seguito di dosi ripetute, con ampie variazioni interindividuali, che possono essere nell'ordine di grandezza di un fattore di 100 (da 4 a 130 ore). Ciò per la diversa variabilità genetica tra gli individui riguardo alla produzione degli isoenzimi CYP3A4, CYP2B6 e CYP2D6; inoltre molte sostanze interferiscono con questi, alterando la emivita del farmaco.
Il metadone oltre alle notevoli variazioni interindividuali ha differenze nella farmacocinetica anche a seguito di dosi singole piuttosto che multiple. L'emivita di eliminazione, infatti, varia notevolmente da 15 a 60 ore, e può essere molto più lunga della 18 ore dichiarate a seguito di una singola dose. Una fine regolazione del dosaggio per ogni singolo paziente è necessaria con le somministrazioni ripetute.
La maggior parte degli studi di farmacocinetica sono stati fatti su soggetti tossicodipendenti. L'enantiomero levogiro (L-metadone) mostra una affinità dieci volte maggiore per il recettore μ, con una potenza analgesica stimata da 8 a 50 volte maggiore rispetto a D-metadone.
Tuttavia, entrambi gli enantiomeri si legano a i recettori NMDA. Allo stesso modo l'effetto terapeutico desiderato del farmaco: l'analgesia e la soppressione di sindrome di astinenza, si trovano quasi interamente con il R-isomero.
Assorbimento
La principale via di somministrazione del metadone è quella orale, infatti, viene rapidamente assorbito dopo somministrazione per via orale ed ha un'alta biodisponibilità orale. Dopo 30 minuti si ritrova nel plasma; il picco ematico è raggiunto dopo circa 4 ore con una dose singola sotto forma di compresse. Il metadone può essere assorbito dalla mucosa buccale. Il picco di concentrazione nel SNC si ottiene dopo 1-2 ore a seguito di una somministrazione intramuscolare o sottocutanea; con queste somministrazioni vi è una relazione lineare tra efficacia e dose somministrata.
Distribuzione
Il metadone subisce una notevole distribuzione nei tessuti e il legame proteico è del 60-90%, in particolare con la glicoproteina α1-acida.
Metabolismo
Il metadone ha due principali metaboliti:
- 2-etilidine-1, 5-dimetil-3,3-difenilpirrolidine (EDDP),
- 2-etil-3,3-difenl-5-metilpirrolidine,
sono entrambi inattivati nel fegato.
Altri metaboliti, sono stati descritti e tra questi il metadolo e il normetadol. È metabolizzato dagli enzimi CYP3A4, CYP2B6 e CYP2D6, con una grande variabilità tra individui. Il N-demetilato dal CYP 3A4 è un metabolita inattivo del metadone.
Il fegato può anche essere un importante sito di accumulo del metadone, che non modificato può spesso essere riciclato nel plasma con ricircolo enteroepatico. Ciò rende difficile la gestione della posologia del farmaco, in quanto questo serbatoio naturale può modificare la cinetica plasmatica del farmaco somministrato ripetutamente.
Eliminazione
I metaboliti vengono escreti con le feci e urine insieme con il metadone non metabolizzato. L'escrezione urinaria di metadone è pH-dipendente, minore è il pH maggiore è l'eliminazione.
Farmacodinamica

1.Membrana cellulare
2.Canale bloccato dal Mg2+ con il blocco del sito (3)
3.Sito Bloccato dal Mg2+
4.Sito di legame per gli allucinogeni
5.Sito di legame per lo Zn2+
6.Sito di legame pergli agonisti(glutamato) e/o antagonisti ligandi(APV)
7.Sito di glicosilazione
8.Sito legante protoni
9.Sito legante la glicina
10.Sito legante le poliammine
11.Spazio extracellulare
12.Spazio intracellualre
13.Subunità del complesso
Il metadone agisce sul complesso recettore ionoforo per il NMDA, su cui agisce il glutammato; essendo questo un mediatore chimico ad azione eccitatoria, il blocco competitivo di questo recettore, operato dal metadone, determina azioni antieccitatorie (si riduce la trasmissione elettrica).
Il metadone approssimativamente ha una potenza equianalgesica pari a 3-4 volte quella della morfina, ma provoca meno euforia ed ha una più duratura azione farmacologica; è molto meglio assorbito rispetto alla morfina e come essa determina stipsi e incrementa la pressione biliare. Inoltre, induce come la morfina dipendenza fisica.
L'impiego principale in algologia del metadone è nei pazienti con dolore oncologico e/o non rispondenti alle morfina o altri oppiacei forti. Inoltre, quando vi sono effetti avversi agli altri oppioidi viene comunemente usato in rotazione con gli oppioidi. Esso possiede diversi vantaggi sia farmacodinamici che farmacocinetici in confronto agli altri oppioidi, quali: un'alta biodisponibilità sia orale che rettale, un'attività analgesica multimodale con un'analgesia di lunga durata, una mancanza di metaboliti attivi, un'escrezione prevalentemente fecale, un basso costo e solamente un debole effetto immunosoppressivo. Al contrario gli svantaggi sono l'alto legame con le proteine plasmatiche e la lunga e variabile emivita plasmatica, un ampio metabolismo con il citocromo P450 e le conseguenti numerose interazioni farmacologiche, la difficoltà nel trovare la dose equianalgesica con gli altri oppioidi ed infine quando somministrato per via sottocutanea la comparsa di reazioni locali. La possibile comparsa di un prolungamento dell'intervallo QT, effetto collaterale che può condurre ad aritmie potenzialmente fatali, è da imputarsi solo all'enantiomero destrogiro del metadone, mentre non si presenta con l'uso del solo L-metadone.
Il metadone è un oppiaceo sintetico unico per le sue caratteristiche farmacologiche. Le differenze più importanti con gli altri oppioidi sono, in primo luogo la sua notevolissima biodisponibilità orale che arriva fino al 90%, inoltre, può essere rilevato nel plasma dopo 30 minuti la somministrazione orale, con livelli plasmatici di picco dopo 4-6 ore. Ciò al contrario dei farmaci oppioidi che hanno un assorbimento scadente e irregolare. In secondo luogo, è la sua variabile e prolungata durata d'azione che può oscillare tra le 12 a le 150 ore dopo una singola dose. Lo steady state può essere raggiunto dopo un giorno o dopo una settimana e ciò può essere spiegato dalle variazioni del citocromo P450 3A (CYP3A) e dall'attività di legame con α1-lipoproteina. Per questi motivi il metadone è inadatto come trattamento di prima linea nel dolore acuto. Inoltre la sua tossicità ritardata può perdurare anche dopo la sospensione dello stesso, a causa del suo accumulo nei compartimenti extra vascolari.
Però il suo particolare profilo farmacocinetico permette la somministrazione una volta al giorno in soggetti con astinenza da oppiacei.
Ancora è molto utile nei programmi di rotazione degli oppiodi in quanto sembra esserci solo una tolleranza parziale con gli altri agonisti oppiodi. Ciò permette il rescue (salvataggio) del soggetto che non risponde più ad un altro oppiode.
Agisce, oltre che sul recettore μ, anche sui recettori NMDA (recettori ionotropici del glutammato). Quest'azione è ben documentata e si è rivelata di grande utilità nel dolore neuropatico dove è possibile usare il metadone con successo. In realtà il farmaco è anche usato in questo tipo di dolore, ma viene soprattutto usato nel dolore cronico oncologico.
Si usa anche di recente nel dolore acuto malgrado la sua cinetica non favorevole, sfruttando in questo caso le formulazioni iniettabili, specie quando vi è una componente nel dolore di tipo neuropatico o vi è una tolleranza ad altri oppioidi come la morfina o fentanil. Ciò specie di fronte a casi difficili di dolore intrattabile; usando la via endovena o la pompa elastomerica (PCA). Questo è però un approccio rischioso per l'alto rischio di accumulo del farmaco nei compartimenti extracellulari.
Si è anche usato per via epidurale nel dolore acuto postoperatorio con buoni risultati, con infusioni continue o intermittenti ad intervalli di "solo 8 ore".
In sintesi, il metadone è un potente agonista oppiaceo con un profilo farmacocinetico che permette una somministrazione orale una volta o due volte al giorno. Ha anche attività antagonista sul recettore NMDA, utile per la sua attività analgesica, soprattutto negli stati di dolore neuropatico. A causa della limitata tolleranza crociata con gli altri oppiacei, può essere di molto utile nella gestione degli stati dolore nocicettivo di pazienti diventati tolleranti ad altri oppioidi di più frequente uso, come la morfina o il fentanil (rotazione degli oppioidi).
Interazioni
I farmaci che acidificano le urine o le alcalinizzano possono avere un effetto importante sulla farmacocinetica del metadone in quanto l'eliminazione corporea (clearance) a pH acido è maggiore; mentre questa diminuisce a pH urinario alcalino.
Molti farmaci andrebbero assunti sotto stretta sorveglianza se si consuma succo di pompelmo, tra questi vi è anche il metadone.
Antibatterici
I sintomi da astinenza sono stati segnalati in pazienti sottoposti a metadone, quando hanno usato la rifampicina che è un potente induttore enzimatico. Invece, con l'uso contemporaneo di ciprofloxacina, che inibisce i citocromi: CYP1A2 e CYP3A4, si hanno segni di tossicità da metadone; con casi di torsione di punta.
Antidepressivi
Gli SSRI come fluoxetina e fluvoxamina e non solo, possono potenziare gli effetti di alcuni analgesici oppioidi; tali interazioni possono determinare la tossicità da metadone quando usati in contemporanea.
Antiepilettici
Sono stati riportati casi di sindrome da astinenza conseguenti all'uso contemporaneo di metadone e antiepilettici quali la carbamazepina, il fenobarbital e la fenitoina.
Antimicotici
L'uso del metadone con il fluconazolo è causa dell'aumento delle concentrazioni sieriche di metadone, anche se non sembra necessario fare un aggiustamento della posologia.
Antivirali
Il metadone aumenta forse le concentrazioni plasmatiche di zidovudina. Vi è una limitata evidence che nelfinavir o ritonavir può ridurre le concentrazioni plasmatiche di metadone.Indinavir e saquinavir non hanno avuto alcun effetto sulle concentrazioni plasmatiche di metadone. Lopinavir-ritonavir insieme possono ridurre le concentrazioni di metadone e determinare torsione di punta.
Nevirapina è stata segnalata come capace di ridurre le concentrazioni plasmatiche di metadone con sintomi di astinenza manifesti quando viene somministrata a pazienti insieme al metadone. Un'interazione simile può esserci quando l'efavirenz è viene assunto insieme al metadone.
Altre interazioni
Altre interazioni degne di nota sono documentate tra il metadone e i seguenti farmaci:
Atracurio,Baclofen,Buprenorfina,Desflurano,Duloxetina,Etomidate,Isoflurano,Ketamina,Linezolid,Mepiramina,Metoclopramide,Procainamide,Propofol,Rocuronio,Trifluoperazina,Amiodarone,Astemizolo,Desipramina,Droperidolo,Gatifloxacina e Rifabutina.
Utilizzo clinico
Indicazioni approvate
Le indicazioni approvate (in label) secondo il foglietto illustrativo, del 01/04/2006, sono:
Sindromi dolorose di entità severa in pazienti che non rispondono più a un trattamento sequenziale con farmaci analgesici, antinfiammatori non steroidei, oppioidi deboli.
Trattamento di disassuefazione da narcotico-stupefacenti. Il trattamento disintossicante e il trattamento di mantenimento devono essere seguiti sotto controllo medico. Se il metadone viene somministrato per il trattamento dell´eroino-dipendenza per più di tre settimane, il procedimento passa dal trattamento della sindrome acuta d´astinenza alla terapia di mantenimento.
Sebbene il metadone generi dipendenza, esso è utilizzato come terapia contro le sindromi d'astinenza da eroina e come terapia a mantenimento per i seguenti motivi:
- Concentrazione nell'arco della giornata quasi costante, basta una somministrazione al giorno.
- La somministrazione orale non ha gli effetti euforizzanti della somministrazione in endovena.
L'uso come analgesico nelle sindromi dolorose di natura oncologica e non, è supportato da una notevole letteratura, e tra questi lavori, vi sono anche studi sulle gravi sindromi dolorose della schiena o Low Back Pain (LBP).
Indicazioni non approvate
Il metadone viene usato in due indicazioni non approvate (Off-label) dalle autorità regolatorie; la prima come anti-tosse e la seconda, ancora sperimentale, come anti-leucemico.
Antitussivo
Il metadone sotto forma di sciroppo ad una concentrazione pari a circa un terzo della concentrazione di metadone liquido utilizzato per la tossicodipendenza da oppiacei, è usato nei paesi ove è reperibile, come uno sciroppo per i violenti accessi di tosse nei malati oncologici. Alcuni studi hanno dimostrato che gli antitussigeni stupefacenti sono utili nella tosse improduttiva; secondo altri studi ciò è discutibile o di nessun beneficio.
Altri oppiacei antitosse
Altri oppiacei naturali e semi-sintetici con effetti antitosse sono:
- codeina,
- etilmorfina,
- diidrocodeina,
- benzilmorfina,
- laudano,
- diidroisocodeina,
- nicocodeina,
- nicodicodeina,
- idrocodone,
- idromorfone,
- acetildiidrocodeina,
- tebacon,
- diamorfina (eroina),
- acetilmorfone,
- noscapine,
- folcodina e
- altri.
Tra gli antitussigeni sintetici vi sono: il dimemotorfano e il destrometorfano e il gruppo dei nelmorfinani, il tipepidina derivata dal tiambutene, e altri farmaci derivati dal metadone, come il levometadone, il normetadone e il levopropossifene.
Trattamento della leucemia
Ricercatori tedeschi hanno scoperto che il metadone è anche, sorprendentemente, un antileucemico per forme resistenti di leucemia. Infatti, uno studio, pubblicato il 1º agosto 2008 su un numero di Cancer Research, una rivista della American Association for Cancer Research, suggerisce che il metadone sia una promettente nuova terapia per la leucemia, in particolare in pazienti che non rispondono alla chemioterapia e alla radioterapia. Due altri studi successivi, suggeriscono un'attività citotossica del metadone potenzialmente utile in questa ed altre indicazioni.
Controindicazioni
Il metadone è gravato da numerose e importanti controindicazioni che ne sconsigliano l'uso in molti tipi di pazienti diversi.
- Attacco asmatico acuto.
- Broncopneumopatia cronica ostruttiva.
- Cardiopatie organiche.
- Cuore polmonare.
- Diabete non compensato.
- Epato e nefropatia.
- Insufficienza respiratoria.
- Ipersensibilità al composto e ai suoi eccipienti.
- Ipertensione intracranica.
- Ipotensione.
- Ipovolemia.
- Porfiria.
- Stipsi grave.
- Traumi cranioencefalici.
Il metadone non è raccomandato nei bambini, per la scarsa documentazione esistente.
Dosi terapeutiche
Analgesia

La dose di metadone cloridrato utilizzata nel trattamento del dolore oncologico o cronico incoercibile va da 2,5 a 10 mg somministrato con intervalli di 3-8 ore a seconda dell'intensità del dolore. Comunemente e inizialmente, il range posologico va 5 a 10 mg ogni 6 a 8 ore regolando il dosaggio del farmaco in base alla risposta.
Per evitare il rischio di accumulo e di sovradosaggio si raccomanda nell'uso prolungato di metadone di non somministrarlo più di due volte al giorno. Può essere somministrato per via orale o per iniezione sottocutanea o intramuscolare. Quando la via parenterale è richiesta, nei pazienti disfagici la via intramuscolare è preferita alla sottocutanea.
Rotazione degli oppioidi
Nei pazienti con dolore a cronico presente da molto tempo a volte è necessario eseguire la cosiddetta rotazione degli oppioidi.
Si intende con essa il passaggio da un oppioide ad un altro, di solito, ad intervalli di circa un paio di settimane e, più comunemente, diversi mesi. La rotazione degli oppioidi è utile, perché il passaggio ad un altro oppioide permette di mantenere basse le dosi, e con ciò meno effetti collaterali, per ottenere l'effetto desiderato.
Quando con il nuovo oppioide, usato in sostituzione del primo, sono necessarie dosi più elevate può crescere la tolleranza e la tossicità in relazione all'aumentare gli effetti analgesici. Allora è il momento ruotare di nuovo verso un altro oppioide. Tale rotazione degli oppioidi è una pratica standard per la gestione di pazienti con problemi di sviluppo di tolleranza. Di solito, quando si fa la rotazione degli oppioidi, non si può scendere ad una dose corrispondente a quella iniziale, perché c'è una tolleranza crociata, che occorre superare con dosi più alte del nuovo oppioide.
Tuttavia, il metadone ha una più bassa tolleranza crociata, quando si passa ad esso da altri oppioidi, rispetto agli altri oppiacei. Questo permette che il metadone può essere iniziato con una dose bassa, e il tempo per il passaggio ad un successivo oppioide è più lungo.
Inoltre, secondo quanto riportato da molti pazienti con dolore, il metadone offre meno sedazione a dosaggio equivalente con altri oppioidi, rendendolo per questo motivo preferibile ad essi. L'uso del metadone è vantaggioso per questo motivo essendo la sedazione una seria complicanza della terapia con oppioidi nel dolore da cancro e nel dolore cronico incoercibile.
Rotazione morfina vs metadone
Per il calcolo delle dosi equivalenti si fa riferimento a tabelle simili a quella riportata. La rotazione di ogni oppioide che va sostituito con il metadone va effettuata in due tappe, prima l'oppioide da sostituire deve essere equiparato al dosaggio equivalente di morfina OS; quindi il dosaggio equivalente di morfina ottenuto va equiparato al rispettivo dosaggio equivalente di metadone secondo le opportune tavole di conversione (vedi dopo).
Per esempio: Fentanil TDS → Morfina OS → Metadone OS
| Dose di morfina | Ratio di conversione a metadone |
|---|---|
| <100 mg/24 h | 1: 3 1 mg metadone ogni 3 mg di morfina |
| 101– 300 mg/24 h | 1: 5 |
| 301– 600 mg/24 h | 1: 10 |
| 601– 800 mg/24 h | 1: 12 |
| 801 - 1-1,000 mg/24 h | 1: 15 |
| > 1.000 mg/24 h | 1: 20 |
Sovradosaggio
Gli effetti tossici del sovradosaggio da metadone possono essere trattati con naloxone. Nonostante la maggior durata d'azione nel tempo del metadone, il naloxone è preferito, con la necessità di dosi ripetute di naloxone nella terapia del trattamento dell'overdose. Il naltrexone ha una emivita più lunga ma è più difficile da titolare. Se una dose eccessiva di antagonista degli oppioidi viene somministrata ad un paziente dipendente, il risultato sarà una crisi d'astinenza anche grave. Quando, invece, si usa il naloxone, esso viene prontamente eliminato e la eventuale crisi d'astinenza dura poco; al contrario le dosi di naltrexone richiedono più tempo per essere eliminato dal paziente.
Il problema dell'overdose da metadone consiste nell'azione fugace del naloxone che una volta terminata costringe a pronte somministrazioni di ulteriori dosi per evitare gli effetti di sovradosaggio subentranti, che sono in funzione dei dosaggi di metadone ingerito.
Effetti collaterali
Gli effetti collaterali più gravi sono: depressione respiratoria e in minor misura da depressione circolatoria, arresto respiratorio, shock ed arresto cardiaco. Raramente casi di prolungamento dell´intervallo QT e casi di torsione di punta.
Gli effetti collaterali più frequenti sono: senso di vuoto alla testa, vertigine, sedazione, nausea, vomito, sudorazione e ipotensione ortostatica.
Altre reazioni avverse sono:
- Sul sistema nervoso centrale: euforia, disforia, debolezza, cefalea, insonnia, agitazione, disorientamento e disturbi visivi.
- Sull'apparato gastroenterico: bocca secca, anoressia, stipsi e spasmo delle vie biliari. Apparato cardiovascolare: rossore al viso, bradicardia, palpitazioni, svenimento e sincope.
- Sull'apparato genito-urinario: ritenzione urinaria o difficoltà alla minzione, effetto antidiuretico e ridotta libido e/o impotenza sessuale.
- Manifestazioni allergiche: prurito, orticaria, altre reazioni cutanee, edema e raramente orticaria vasculitica.
Il glicerolo presente nella composizione può determinare: mal di testa, disturbi di stomaco e diarrea. Il sodio benzoato può determinare: irritazione delle mucose. Inoltre, può aumentare il rischio di itterizia nel neonato.
Un edema polmonare di tipo ritardato può insorgere a seguito della somministrazione in vena del metadone, esso agisce attraverso meccanismi di tipo centrale che modificano la permeabilità capillare polmonare.
Sono diversi gli agenti tossici che indirettamente possono indurre un'attivazione metabolica con interessamento della cellule della teca e della granulosa ovarica tra questi l'eroina e il metadone che hanno un effetto attivante l'asse ipotalamo-ipofisi. Inoltre, il metadone è sospettato di indurre una tossicità nelle prime fasi dello sviluppo per trasmissione parentale attraverso la placenta.
La sindrome di astinenza neonatale si verifica tra i 30 e il 90% dei neonati esposti in utero all'eroina o al metadone. I sintomi dell'astinenza neonatale sono più frequenti se la dose di metadone quotidiana assunta dalla madre supera i 20 mg. La maggior parte dei neonati avranno sintomi da sospensione brusca e diventano sintomatici 48 ore dopo il parto, ma si segnalano anche crisi di astinenza nei neonati che iniziano a distanza 7-14 giorni dopo il parto. In questi casi l'allattamento al seno è protettivo nei confronti della sindrome da astinenza del neonato.
Molti studi suggeriscono che donne, che fanno terapia di mantenimento con metadone, durante la gravidanza, avranno un aumento di peso del feto e una gestazione più lunga. Pur presentando i neonati un peso alla nascita e una circonferenza cranica inferiore. Mentre non si rileva alcun aumento dei difetti congeniti nella prole delle donne che consumano in gravidanza metadone. L'uso in gravidanza nelle donne che intendono sospendere l'assunzione di eroina, è possibile, purché ciò sia fatto sotto stretto controllo medico. Il farmaco può essere usato fino alla fine della gravidanza con dosaggi stabili. L'eventuale sospensione del trattamento va effettuato sotto stretto controllo di medici specialisti e non andrebbe mai fatto prima della XIV settimana di gestazione e non dopo la XXXII, per evitare il rischio di aborto e di parto pretermine, rispettivamente. Il farmaco non può essere usato durante il travaglio di parto.
Il medicinale contiene saccarosio: 1 ml di sciroppo contiene 0.4 g di zucchero. Questo va tenuto presente nei soggetti diabetici compensati. La massima dose giornaliera comporta l'assunzione di 48 g di zucchero; è quindi sconsigliato per i pazienti che soffrono di intolleranza ereditaria al fruttosio, di disturbi nell'assorbimento degli zuccheri: glucosio e galattosio, o di mancanza degli enzimi: sucrasi e isomaltasi, necessari alla digestione degli zuccheri.
Dipendenza
Il metadone cloridrato è usato come parte del trattamento della dipendenza da oppiacei, anche se con l'uso prolungato di metadone si può determinare dipendenza. Nel trattamento dell'astinenza da oppioidi, o nella detossificazione da questi, il metadone è somministrato inizialmente in dosi sufficienti a sopprimere i sintomi di astinenza. Scopo di queste terapie è quello di garantire un'accettabile vita sociale e lavorativa dei tossicodipendenti evitando anche così fenomeni criminali legati alla ricerca della dose quotidiana di stupefacente.
Una miscela contenente 1 mg/ml di metadone cloridrato viene comunemente utilizzata per le persone dipendenti da oppiacei. Una dose giornaliera da 10 a 20 mg di metadone cloridrato per via orale può essere somministrata inizialmente e, se necessario, aumentata da 10 a 20 mg al giorno fino a quando non si manifestano segni di crisi di astinenza o di intossicazione. Dopo la stabilizzazione, che spesso è raggiunta con una dose giornaliera di 40 a 60 mg, la dose di metadone va gradualmente diminuita fino al raggiungimento della sospensione totale.
Dosi simili possono anche essere somministrato per iniezione sottocutanea o intramuscolare. Alcuni schemi di trattamento per la dipendenza da oppiacei possono anche prevedere una terapia di mantenimento con metadone molto prolungata nel tempo, questa viene regolata sulle esigenze personali dell'individuo con una dose giornaliera. Sono stati riportati casi di soggetti trattati con 120 mg o più al giorno.
In Italia una serie di regolamenti di polizia sanitaria e norme giuridiche regolamentano la distribuzione ed assunzione della terapia sostitutiva nelle tossicodipendenze con il metadone; la somministrazione del metadone avviene in strutture chiamate SERT.
Bibliografia
Linee guida
Le Linee guida pubblicate nel mondo che riguardano il metadone sono n. 10, secondo una ricerca effettuata su Pubmed ed aggiornata al 25 febbraio 2011; così suddivise per argomento:
Linee guida nel dolore oncologico
- Hanks GW, Conno F, Cherny N, et al., Morphine and alternative opioids in cancer pain: the EAPC recommendations, in Br. J. Cancer, vol. 84, n. 5, marzo 2001, pp. 587–93, DOI:10.1054/bjoc.2001.1680, PMC 2363790, PMID 11237376.
Linee guida nel dolore non oncologico
- Chou R, Fanciullo GJ, Fine PG, et al., Clinical guidelines for the use of chronic opioid therapy in chronic noncancer pain, in J Pain, vol. 10, n. 2, febbraio 2009, pp. 113–30, DOI:10.1016/j.jpain.2008.10.008, PMID 19187889.
- Trescot AM, Helm S, Hansen H, et al., Opioids in the management of chronic non-cancer pain: an update of American Society of the Interventional Pain Physicians' (ASIPP) Guidelines , in Pain Physician, vol. 11, 2 Suppl, marzo 2008, pp. S5–S62, PMID 18443640.
- Moulin DE, Clark AJ, Gilron I, et al., Pharmacological management of chronic neuropathic pain - consensus statement and guidelines from the Canadian Pain Society, in Pain Res Manag, vol. 12, n. 1, 2007, pp. 13–21, PMC 2670721, PMID 17372630. URL consultato il 5 gennaio 2012 (archiviato dall'url originale il 10 novembre 2012).
- Moulin DE, Clark AJ, Gilron I, et al., Pharmacological management of chronic neuropathic pain - consensus statement and guidelines from the Canadian Pain Society, in Pain Res Manag, vol. 12, n. 1, 2007, pp. 13–21, PMC 2670721, PMID 17372630. URL consultato il 5 gennaio 2012 (archiviato dall'url originale il 10 novembre 2012).
Linee guida nelle tossicodipendenze
- (NL) Westra M, de Haan HA, Arends MT, van Everdingen JJ, Klazinga NS, [Guideline 'Medicinal care for drug addicts in penal institutions'], in Ned Tijdschr Geneeskd, vol. 153, 2009, pp. A726, PMID 20051159.
- (ES) Miró JM, Torre-Cisnero J, Moreno A, et al., [GESIDA/GESITRA-SEIMC, PNS and ONT consensus document on solid organ transplant (SOT) in HIV-infected patients in Spain (March, 2005)], in Enferm. Infecc. Microbiol. Clin., vol. 23, n. 6, 2005, pp. 353–62, PMID 15970168.
- (FR) Michel L, Maguet O, [Guidelines for substitution treatments in prison populations], in Encephale, vol. 31, 1 Pt 1, 2005, pp. 92–7, PMID 15971645.
- Barry J, Bourke M, Buckley M, et al., Hepatitis C among drug users: consensus guidelines on management in general practice, in Ir J Med Sci, vol. 173, n. 3, 2004, pp. 145–50, PMID 15693384.
- Fiellin DA, Barthwell AG, Guideline development for office-based pharmacotherapies for opioid dependence, in J Addict Dis, vol. 22, n. 4, 2003, pp. 109–20, PMID 14723481.
- Yoast R, Williams MA, Deitchman SD, Champion HC, Report of the Council on Scientific Affairs: methadone maintenance and needle-exchange programs to reduce the medical and public health consequences of drug abuse, in J Addict Dis, vol. 20, n. 2, 2001, pp. 15–40, DOI:10.1300/J069v20n02_03, PMID 11318395.
Testi
Farmacologia e clinica
- (EN) Jane C Ballantyne, Scott M Fishman e James P. Rathmell, Bonica's Management of Pain, Lippincott Williams & Wilkins, 1º ottobre 2009, pp. 1186–, ISBN 978-0-7817-6827-6.
- (EN) Gerald Briggs, Roger K. Freeman e Sumner J. Yaffe, Drugs in Pregnancy and Lactation: A Reference Guide to Fetal and Neonatal Risk, Lippincott Williams & Wilkins, 29 marzo 2011, pp. 916–, ISBN 978-1-60831-708-0. URL consultato il 5 gennaio 2012.
- (EN) accessdate Eduardo Bruera e Russell K. Portenoy, Cancer pain: assessment and management, Cambridge University Press, 2003, pp. 122–, ISBN 978-0-521-77332-4.
- (EN) Laurence L. Brunton, Louis Sanford Goodman, Donald Blumenthal, Iain Buxton, Goodman and Gilman's manual of pharmacology and therapeutics, McGraw-Hill Professional, 28 settembre 2007, ISBN 978-0-07-144343-2.
- (EN) Bruce Chabner, Thomas J. Lynch e Dan L. Longo, Harrison's Manual of Oncology, McGraw Hill Professional, 11 novembre 2007, ISBN 978-0-07-141189-9.
- (EN) John P. Cloherty, Eric C. Eichenwald e Ann R. Stark, Manual of neonatal care, Lippincott Williams & Wilkins, 2008, pp. 217–, ISBN 978-0-7817-6984-6.
- (EN) Derek Doyle, Geoffrey Hanks e Nathan I. Cherny, Oxford textbook of palliative medicine, Oxford University Press, 11 gennaio 2005, pp. 324–, ISBN 978-0-19-856698-4.
- (EN) Manuchair Ebadi, Desk Reference of Clinical Pharmacology, 2ª ed., CRC Press, 2007, ISBN 1-4200-4743-4.
- (EN) Wanda M. Haschek, Colin George Rousseaux e Matthew A. Wallig, Fundamentals of toxicologic pathology, Amsterdam, Elsevier/Academic Press, 2010, ISBN 0-12-370469-3.
- Sebastiano Mercadante, Il dolore nel paziente neoplastico, Elsevier srl, 2009, pp. 142–, ISBN 978-88-214-3067-1.
- Gian Paolo Novelli, Roberta Casali e Rocco D. Mediati, Terapia del dolore, SEE Editrice Firenze, 1999, pp. 80–, ISBN 978-88-8465-021-4.
- (EN) Alan F. Schatzberg, Jonathan O. Cole e Charles DeBattista, Manual of Clinical Psychopharmacology, American Psychiatric Pub, 8 aprile 2010, pp. 573–, ISBN 978-1-58562-377-8.
- (EN) Michael D. Stubblefield, Cancer rehabilitation principles and practice, Demos Medical Publishing, 22 aprile 2009, pp. 488–, ISBN 978-1-933864-33-4. URL consultato il 5 gennaio 2012.
- (EN) Anthony J. Trevor, Bertram G. Katzung e Susan B. Masters, Katzung and Trevor's pharmacology, McGraw-Hill Professional, 11 dicembre 2007, pp. 264–, ISBN 978-0-07-148869-3.
- (EN) Nalini Vadivelu, Essentials of Pain Management, Springer, 3 marzo 2011, pp. 686–, ISBN 978-0-387-87578-1. URL consultato il 5 gennaio 2012.
- (EN) D. A. Warrell, Timothy M. Cox e John D. Firth, Oxford textbook of medicine, Oxford University Press, 2003, pp. 1015–, ISBN 978-0-19-857014-1.
- (EN) Connie Henke Yarbro, Michelle Goodman e Margaret Hansen Frogge, Cancer Nursing: Principles and Practice, Jones & Bartlett Learning, 21 aprile 2010, ISBN 978-0-7637-6357-2.
Tossico-dipendenze
- Carlo Barbera, Giuseppe De Carlo e Luca De Carlo, Testo unico di pubblica sicurezza, Maggioli Editore, 2008, ISBN 978-88-387-4029-9.
- Umberto Nizzoli, Trattato completo degli abusi e delle dipendenze, PICCIN, 2002, pp. 753–, ISBN 978-88-299-1648-1.
- Marcello Cesa-Bianchi, Aspetti psicologici della tossicodipendenza in una metropoli: ricerche su l'adolescente, la famiglia, il medico, Editoriale Jaca Book, 1987, pp. 200–, ISBN 978-88-16-95031-3.
- Celeste Franco Giannotti, Dipendenze: la qualità della cura nei servizi, FrancoAngeli, 2003, pp. 171–, ISBN 978-88-464-5102-6.
- G. Strepparola, Curare gli eroinomani: l'uso del metadone nel panorama italiano ed europeo, FrancoAngeli, 2005, pp. 23–, ISBN 978-88-464-6505-4.
- Luca Fazzi e Antonio Scaglia, Tossicodipendenza e politiche sociali in Italia, FrancoAngeli, 2001, pp. 115–, ISBN 978-88-464-2945-2.
- Paolo Rigliano, Piaceri drogati. Psicologia del consumo di droghe, Feltrinelli Editore, 2004, pp. 166–, ISBN 978-88-07-81790-8.
- Mauro Cibin e G. P. Guelfi, Il trattamento con metadone, FrancoAngeli, 2004, pp. 239–, ISBN 978-88-464-5604-5.
- Giorgio Pietrostefani, Il sistema droga. Per capire le cause e punire di meno, Editoriale Jaca Book, 1998, pp. 164–, ISBN 978-88-16-28050-2.
- (EN) Joyce H. Lowinson, Pedro Ruiz e Robert B. Millman, Substance abuse: a comprehensive textbook, Lippincott Williams & Wilkins, 2005, pp. 1246–, ISBN 978-0-7817-3474-5.
- (EN) Cath Harrison e Alan Gibson, Practical Neonatology for MRCPCH and Beyond, Churchill-Livingston, 25 settembre 2009, pp. 28–, ISBN 978-0-443-07070-9.
- (EN) Harold E. Doweiko, Concepts of Chemical Dependency, Cengage Learning, 2009, pp. 389–, ISBN 978-0-495-50580-8.
- (EN) Kathleen M. King, Methadone-Associated Overdose Deaths: Factors Contributing to Increased Deaths and Efforts to Prevent Them, DIANE Publishing, June 2010, ISBN 978-1-4379-1471-9.
Voci correlate
Altri progetti
Altri progetti
-
 Wikiquote contiene citazioni di o su metadone
Wikiquote contiene citazioni di o su metadone
-
 Wikizionario contiene il lemma di dizionario «metadone»
Wikizionario contiene il lemma di dizionario «metadone» -
 Wikimedia Commons contiene immagini o altri file su metadone
Wikimedia Commons contiene immagini o altri file su metadone
Collegamenti esterni
- Il metadone: come funziona, su sims.it.
- Farmacopea - METADONE CLORIDR*SCIR 10MG10ML, su salus.it. URL consultato il 25 febbraio 2011 (archiviato dall'url originale il 26 giugno 2015).
- (EN) www.ncbi.nlm.nih.gov, su ncbi.nlm.nih.gov.
- (EN) www.drugs.com/methadone.html, su drugs.com.
- (EN) www.rxlist.com/dolophine-drug.htm, su rxlist.com.
- (EN) withdrawal-symptoms-methadone/, su withdrawalsymptomsmethadone.com. URL consultato il 25 febbraio 2011 (archiviato dall'url originale il 27 febbraio 2011).
| Controllo di autorità | LCCN (EN) sh85084373 · GND (DE) 4038959-5 · J9U (EN, HE) 987007529211305171 · NDL (EN, JA) 00567621 |
|---|