
Naftalene
| Naftalene | |
|---|---|
 | |
 | |
 | |
| Nome IUPAC | |
| naftalene | |
| Nomi alternativi | |
| naftalina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C10H8 |
| Peso formula (u) | 128,16 |
| Aspetto | solido cristallino bianco |
| Numero CAS | 91-20-3 |
| Numero EINECS | 202-049-5 |
| PubChem | 931 |
| SMILES |
C1=CC=C2C=CC=CC2=C1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,15 |
| Solubilità in acqua | 0,03 g/l a 293 K |
| Temperatura di fusione | 79 °C (352 K) |
| Temperatura di ebollizione | 218 °C (491 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | 78,5 |
| ΔfG0 (kJ·mol−1) | 201,6 |
| S0m(J·K−1mol−1) | 167,4 |
| C0p,m(J·K−1mol−1) | 165,7 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| Frasi H | 228 - 351 - 300 - 302 - 410 |
| Consigli P | 210 - 280 - 301+312+330 - 370+378 |
Il naftalene, commercialmente noto anche come naftalina, è un idrocarburo aromatico biciclico, di formula chimica C10H8; è il più semplice tra gli idrocarburi policiclici aromatici.
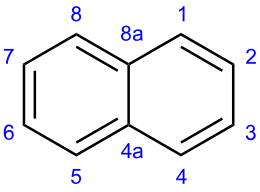
La sua molecola è planare; la struttura è quella di due anelli benzenici condensati, ovvero che condividono due atomi di carbonio adiacenti.
È l'ingrediente caratteristico delle tradizionali palline antitarme utilizzate negli armadi per proteggere i capi di lana.
Indice
Storia
Agli inizi del 1820 due studi riportarono la descrizione di un solido bianco, caratterizzato da odore pungente e derivato dal catrame di carbone. Nel 1821 John Kidd citò questi due studi e descrisse le proprietà e il metodo di produzione di questa sostanza, proponendo di chiamarla naftalina, in quanto era un derivato di quello che allora rientrava sotto il nome generico di nafta.
La formula chimica del naftalene fu poi determinata da Michael Faraday nel 1826, mentre la sua struttura risultante dalla fusione di due anelli benzenici fu proposta da Emil Erlenmeyer nel 1866, e confermata tre anni più tardi da Carl Gräbe.
Produzione naturale e industriale
Industrialmente si ottiene per distillazione dal catrame, dal carbone e dal petrolio.
In natura tracce di naftalene sono prodotte dalle magnolia e da alcune specie di cervi, oltre che dalle termiti di Formosa (Coptotermes formosanus) probabilmente come repellente contro le formiche, i funghi velenosi e i vermi nematodi.
Anche alcune varietà del fungo endofita Muscodor albus producono naftalene assieme ad altri composti organici volatili, mentre il Muscodor vitigenus produce pressoché esclusivamente naftalene.
Tracce di naftalene sono state trovate anche in alcune meteoriti rilevate dalla seguente reazione: n C10H7-SO3H + n CH2O → SO3H-C10H7-(-CH2-C10H7-SO3H)n + n H2O
Caratteristiche
A temperatura ambiente è un solido cristallino bianco dall'odore intenso e caratteristico, rilevabile già a concentrazioni di 0,08 ppm.. Poco solubile in acqua, si scioglie abbastanza bene nell'etanolo (77 g/l a 20 °C) e ancora meglio nei solventi organici. Può facilmente sublimare.
Oltre all'impiego nell'industria chimica principalmente come materia prima per la sintesi dell'anidride ftalica e di coloranti (Acido H), trova uso domestico anche come insetticida, specialmente contro le tarme. In passato è stato utilizzato come combustibile nel campo automobilistico e ferroviario, ma necessitava di un altro carburante per avviare il motore e portarlo alla temperatura di esercizio di 80 °C per sciogliere la naftalina.
Dal punto di vista chimico la sua aromaticità è minore di quella del benzene: una conseguenza di ciò è che i suoi legami sono di lunghezze diverse. Il naftalene brucia con fiamma fuligginosa; dal punto di vista chimico reagisce con sostanze ossidanti quali il permanganato di potassio per dare l'acido ftalico, oppure in condizioni di ossidazione più blande, per esempio con anidride cromica, un naftochinone. Può essere inoltre ridotto con sodio metallico in ammoniaca liquida e etanolo (condizioni della riduzione di Birch) a dare l'1,4 diidronaftalene. Inoltre come il benzene, subisce facilmente reazioni di sostituzione elettrofila aromatica, orientate prevalentemente in posizione α (posizione 1), in misura minore la sostituzione può avvenire in β (posizione 2), che è meno reattiva, ma anche meno ingombrata a livello sterico.

Per idrogenazione catalitica viene convertito in decalina (decaidronaftalene), oppure in condizione catalitiche differenti in tetralina (1,2,3,4-tetraidronaftalene). Per ottenere il prodotto completamente ridotto è noto l'uso di Rh/C o Pt/C come catalizzatore, mentre per il secondo catalizzatori quali Ni o Pd/C in ogni caso a temperatura e pressione elevata.
Precauzioni
L'esposizione eccessiva al naftalene provoca la distruzione dei globuli rossi e produce sintomi di nausea, vomito, diarrea, passaggio di sangue nelle urine e pallore della pelle. È inoltre un sospetto cancerogeno di categoria 3 (secondo la classificazione della Comunità Europea (CE)), «sostanze da considerare con sospetto per i possibili effetti cancerogeni nell'uomo, per le quali tuttavia le informazioni disponibili sono insufficienti per procedere a una valutazione soddisfacente; esistono alcune prove ottenute con adeguati studi sugli animali che non bastano per classificare queste sostanze nella categoria 2».
Voci correlate
Altri progetti
Altri progetti
-
 Wikizionario contiene il lemma di dizionario «naftalene»
Wikizionario contiene il lemma di dizionario «naftalene» -
 Wikimedia Commons contiene immagini o altri file su naftalene
Wikimedia Commons contiene immagini o altri file su naftalene
Collegamenti esterni
- (EN) Naftalene, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Nitrazione del naftalene in laboratorio e meccanismo di reazione , su itiskennedy.it.
| Controllo di autorità | Thesaurus BNCF 29641 · LCCN (EN) sh85089710 · GND (DE) 4171151-8 · BNF (FR) cb122930669 (data) · J9U (EN, HE) 987007558118205171 · NDL (EN, JA) 00575297 |
|---|