
Ossido arsenioso
| Ossido arsenioso | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| triossido di diarsenico | |
| Nomi alternativi | |
| triossido di arsenico,anidride arseniosa, sesquiossido di arsenico, arsenico bianco, ossido di arsenico(III) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | As2O3 |
| Massa molecolare (u) | 197,84 |
| Aspetto | solido bianco cristallino |
| Numero CAS | 1327-53-3 |
| Numero EINECS | 215-481-4 |
| PubChem | 261004 |
| DrugBank | DBDB01169 |
| SMILES |
O=[As]O[As]=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 3,865 (arsenolite) 4,15 (claudetite) |
| Solubilità in acqua | 17 g/L a 16 °C |
| Temperatura di fusione | 275 °C (527 °F) (arsenolite) |
| Temperatura di ebollizione | 460 °C (860 °F) |
| Sistema cristallino | polimorfo |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | –1313,9 (arsenolite) |
| S0m(J·K−1mol−1) | 214 (arsenolite) |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 14,6 oral rat |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
   
| |
| pericolo | |
| Frasi H | 300 - 314 - 350 - 410 |
| Consigli P | 201 - 280 - 301+310 - 330 - 303+361+353 - 304+340 - 305+351+338 - 308+313 |
L'ossido arsenioso o triossido di diarsenico è un composto inorganico con formula As2O3, dove l'arsenico ha numero di ossidazione +3. Questo ossido è il composto commercialmente più importante dell'arsenico, usato come base di partenza per altri composti dell'arsenico, compresi i composti organoarsenicali. Nel 1991 ne sono state prodotte quasi 50000 tonnellate. Molte sue applicazioni sono controverse data l'alta tossicità dei composti dell'arsenico.
Indice
Struttura
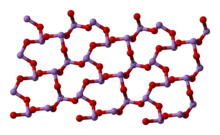
Il composto dà luogo a due modificazioni cristalline, che si osservano anche nei due minerali arsenolite e claudetite. La forma più comune è la arsenolite che ha struttura cristallina cubica; consiste di dimeri As4O6, isostrutturali con P4O6, disposti con un arrangiamento tipo diamante. Per riscaldamento si ottiene la forma monoclina claudetite, che consiste di strati di piramidi AsO3 che condividono gli atomi di ossigeno. In fase gassosa esistono molecole As4O6 che sopra gli 800 °C iniziano a dissociarsi formando il monomero As2O3. La condensazione del vapore al di sotto dei 250 °C dà arsenolite mentre al di sopra di questa temperatura si forma As2O3 vetroso.
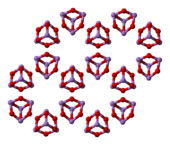
|

|
|
arsenolite (cubica) |
claudetite I (monoclina) |
claudetite II
(monoclina) |
Sintesi

Industrialmente la maggior parte del triossido di arsenico viene ottenuto come sottoprodotto da minerali arsenicali che vengono trattati con lo scopo principale di ricavare metalli pregiati presenti in piccole quantità. I minerali più usati sono arsenopirite (FeAsS) e löllingite (FeAs2). Il minerale viene arrostito in condizioni accuratamente controllate in modo da formare composti volatili dell'arsenico, evitando di formare composti come As2O5 o arsenati, che rimarrebbero nel materiale arrostito. È importante ottenere un residuo con un basso tenore di arsenico, in modo da semplificare i trattamenti successivi dei residui, dai quali si ricavano metalli preziosi come argento, oro e rame, ma anche nichel, cobalto, piombo. I composti volatili contenenti arsenico vengono condensati, separati e trattati ulteriormente con tecniche diverse a seconda della effettiva composizione, fino ad arrivare a As2O3 al 95-99%. Solo in Cina i minerali arsenicali sono trattati con lo scopo principale di ottenere arsenico.
In laboratorio il triossido di arsenico si può preparare bruciando arsenico elementare, o per idrolisi del tricloruro di arsenico:
Reattività
Il triossido di arsenico è un ossido anfotero, poco solubile in acqua, dove forma soluzioni debolmente acide contenenti principalmente la specie As(OH)3. Questa specie non è mai stata isolata, ma si prevede che abbia una struttura piramidale. In ambiente alcalino la solubilità è maggiore, e per successiva deprotonazione di As(OH)3 a seconda del pH si formano le specie [AsO(OH)2]–, [AsO2(OH)]2– e [AsO3]3–.
Con HF e HCl anidri reagisce formando rispettivamente AsF3 e AsCl3:
Il triossido di arsenico deve essere trattato con ossidanti molto forti come ozono, perossido di idrogeno e acido nitrico per riuscire a ottenere il pentossido di arsenico o l'acido corrispondente:
Il triossido di arsenico è quindi più resistente all'ossidazione del congenere triossido di fosforo, che per semplice riscaldamento brucia all'aria formando pentossido di fosforo.
Per riduzione di As2O3 si ottiene arsenico elementare o arsina (AsH3) a seconda delle condizioni usate. Questa reazione è stata utilizzata in passato nel saggio di Marsh per determinare tracce di arsenico.
Usi
Il triossido di arsenico è usato su larga scala come materiale di partenza per la produzione di preservanti per il legno come l'arseniato di rame. Questi preservanti sono largamente usati negli Stati Uniti d'America e in Malaysia, ma questo utilizzo è controverso e vietato in molte altre nazioni.
È inoltre usato per produrre erbicidi e insetticidi, nella conservazione delle pelli, come decolorante nell'industria del vetro, per preparare arsenico elementare e altri composti dell'arsenico, nell'industria elettronica. Nel passato era usato per ottenere il pigmento verde di Parigi e il farmaco Neosalvarsan.
Il triossido di arsenico ha il pregio di essere uno standard primario e per questo viene utilizzato in chimica analitica per standardizzare gli ossidanti usati in volumetria.
Applicazioni in medicina
Nonostante la tossicità dell'arsenico sia ben nota, il triossido di arsenico è stato utilizzato in medicina a partire dalla medicina tradizionale cinese, dove è noto come Pi Shuang ed è ancora usato per curare il cancro e altre malattie. In omeopatia è chiamato arsenicum album. Il triossido di arsenico era contenuto in varie specialità medicinali risultate in seguito inefficaci o pericolose, come la soluzione di Fowler.
Nel 1970 alcuni ricercatori cinesi hanno studiato se il triossido di arsenico usato nella medicina tradizionale cinese potesse essere impiegato nel trattamento della leucemia promielocitica acuta. In seguito, studi di ricercatori sia cinesi che occidentali portarono allo sviluppo del farmaco Trisenox, che nel 2000 fu approvato dalla Food and Drug Administration (FDA) per il trattamento della leucemia. Con il nome depositato Trisenox il triossido di arsenico è un chemioterapico approvato dalla FDA per i casi di leucemia promielocitica acuta che non rispondono a farmaci d'elezione come la tretinoina. È stato dimostrato che il triossido di arsenico induce apoptosi nelle cellule cancerose. Questo medicinale implica rischi significativi, data la tossicità dell'arsenico. L'uso combinato di triossido di arsenico e tretinoina è stato approvato dalla FDA per il trattamento di alcuni tipi di leucemia. All'Università di Hong Kong è stato anche sviluppato un farmaco contenente triossido di arsenico che può essere somministrato per via orale anziché endovenosa.
Tossicologia
Le proprietà tossiche del triossido di arsenico sono leggendarie e trattate estesamente in letteratura. Il triossido di arsenico viene assorbito rapidamente dal sistema digestivo. Sono noti anche effetti tossici per inalazione o contatto cutaneo. L'eliminazione è inizialmente rapida, con emivita di 1-2 giorni, in seguito a metilazione per formare acido monometilarsonico e acido dimetilarsonico, che vengono escreti con le urine. Tuttavia una certa quantità, che può essere il 30-40% in caso di esposizione ripetuta, viene incorporata in ossa, muscoli, pelle, capelli e unghie (tutti tessuti ricchi di cheratina) e viene eliminata in settimane o mesi.
I primi sintomi di avvelenamento acuto da arsenico sono a livello digestivo: vomito, dolori addominali, diarrea spesso accompagnata da sanguinamento. Dosi sub-letali possono dare convulsioni, problemi cardiovascolari, infiammazioni al fegato e ai reni, e anomalie nella coagulazione sanguigna. In seguito appaiono caratteristiche striature bianche sulle unghie (linee di Mees) e si ha caduta di capelli. Dosi minori provocano problemi a fegato e reni e variazioni della pigmentazione cutanea. Soluzioni anche diluite di triossido di arsenico sono pericolose per contatto con gli occhi.
L'avvelenamento cronico da arsenico è noto come arsenicosi. Questa patologia colpisce operai di fonderia, persone che bevono acqua potabile contenente quantità elevate di arsenico (0,3-0,4 ppm), e pazienti sottoposti a lunghi trattamenti con farmaci arsenicali. Studi su lavoratori in fonderie di rame di Stati Uniti, Giappone e Svezia indicano per i lavoratori più esposti un rischio di tumori ai polmoni 6–10 volte maggiore rispetto alla popolazione normale. L'ingestione per lunghi periodi di triossido di arsenico da acqua potabile o da medicinali può provocare tumori alla pelle. Si sono anche osservati problemi riproduttivi in uno studio su donne esposte a polveri di triossido di arsenico dato che erano impiegate o vivevano nei pressi di fonderie di rame.
In Austria esistono i cosiddetti "mangiatori d'arsenico di Stiria", persone che ingeriscono senza alcun problema apparente triossido di arsenico in dosi ben maggiori della dose letale.
Bibliografia
- (DE) R. M. Allesch, Arsenik. Seine Geschichte in Österreich, in Archiv für vaterländische Geschichte und Topographie, vol. 54, Klagenfurt, Kleinmayr, 1959.
- (EN) K. H. Antman, Introduction: The history of arsenic trioxide in cancer therapy, in Oncologist, vol. 6, Supplement 2, 2001, pp. 1-2, PMID 11331433.
- (EN) W.-Y. Au, C. R. Kumana, M. Kou e altri, Oral arsenic trioxide in the treatment of relapsed acute promyelocytic leukemia, in Blood, vol. 102, n. 1, 2003, pp. 407–408, DOI:10.1182/blood-2003-01-0298.
- I. Bertini e F. Mani, Chimica Inorganica, CEDAM, ISBN 88-13-16199-9.
- (EN) Z. Bian, S. Chen, C. Cheng, J. Wang, H. Xiao e H. Qin, Developing new drugs from annals of Chinese medicine, in Acta Pharmaceutica Sinica B, vol. 2, n. 1, 2012, pp. 1-7, DOI:10.1016/j.apsb.2011.12.007.
- (EN) G. Brauer, Handbook of preparative inorganic chemistry, vol. 1, 2ª ed., New York, Academic Press, 1963, ISBN 0-323-16127-8.
- (EN) G. O. Doak, G. G. Long e L. D. Freedman, Arsenic compounds, in Kirk-Othmer Encyclopedia of Chemical Technology, 4ª ed., John Wiley & Sons, 1998.
- (EN) J. Emsley, Arsenic, in The elements of murder, Oxford, Oxford University Press, 2005, ISBN 0-19-280599-1.
- Gustave Flaubert, Madame Bovary, 1856.
- GESTIS, Diarsenic trioxide, su gestis-en.itrust.de. URL consultato il 17 novembre 2015. Pagina del triossido di arsenico nel data base GESTIS.
- (EN) S. Gibaud e G. Jaouen, Arsenic-Based Drugs: From Fowler's Solution to Modern Anticancer Chemotherapy, in Topics in Organometallic Chemistry, vol. 32, 2010, pp. 1–20, DOI:10.1007/978-3-642-13185-1_1.
- (EN) M. Gielen e E. R. Tiekink (a cura di), Metallotherapeutic Drugs and Metal-Based Diagnostic Agents: The Use of Metals in Medicine, Wiley, 2008, ISBN 0-470-86403-6.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) S. C. Grund e K. Hanusch, Arsenic and arsenic compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a03_113.
- (EN) Arsenic Eaters, in New York Times, 26 luglio 1885.
- (EN) P. Patnaik, Handbook of inorganic chemicals, New York, McGraw-Hill, 2003, ISBN 0-07-049439-8.
- (EN) G. Przygoda, J. Feldmann e W. R. Cullen, The arsenic eaters of Styria: a different picture of people who were chronically exposed to arsenic, in Applied Organometallic Chemistry, vol. 15, n. 6, 2001, pp. 457–462, DOI:10.1002/aoc.126.
- (EN) Y. Rao, R. Li e D. Zhang, A drug from poison: how the therapeutic effect of arsenic trioxide on acute promyelocytic leukemia was discovered, in Sci. China Life Sci., vol. 56, n. 6, 2013, pp. 495–502, DOI:10.1007/s11427-013-4487-z.
- (EN) S. L. Soignet, S. R. Frankel, D. Douer e altri, United States multicenter study of arsenic trioxide in relapsed acute promyelocytic leukemia, in J. Clin. Oncol., vol. 19, n. 18, 2001, pp. 3852-60, PMID 11559723.
- (EN) J. C. Whorton, The Arsenic Century: How Victorian Britain was Poisoned at Home, Work, and Play, 1ª ed., Oxford University Press, 2011, ISBN 978-0-19-960599-6.
- (EN) J. Zhu, Z. Chen, V. Lallemand-Breitenbach e H. De Thé, How acute promyelocytic leukaemia revived arsenic, in Nature Reviews Cancer, vol. 2, n. 9, 2002, pp. 705–714, DOI:10.1038/nrc887.
Voci correlate
Altri progetti
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su ossido arsenioso
Wikimedia Commons contiene immagini o altri file su ossido arsenioso



