
Ossido di antimonio(III)
| Ossido di antimonio(III) | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Ossido di antimonio(III), triossido di diantimonio | |
| Nomi alternativi | |
| Triossido di antimonio, sesquiossido di antimonio, ossido di antimonio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | Sb2O3 |
| Massa molecolare (u) | 291,50 |
| Aspetto | solido bianco |
| Numero CAS | 1309-64-4 |
| Numero EINECS | 215-175-0 |
| PubChem | 16684270 |
| SMILES |
O=[Sb]O[Sb]=O e [O-2].[O-2].[O-2].[Sb+3].[Sb+3] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 5,2 (cubico) 5,8 (ortorombico) |
| Solubilità in acqua | praticamente insolubile |
| Temperatura di fusione | 655 °C (928 K) |
| Temperatura di ebollizione | 1 425 °C (1 698 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | –720,3 (cubico) –708,5 (ortorombico) |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | > 34600 oral rat |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 351 |
| Consigli P | 281 - 308+313 |
Il triossido di diantimonio o ossido di antimonio(III) è il composto inorganico di formula Sb2O3. In condizioni normali è un solido bianco praticamente insolubile in acqua, ed è il composto di antimonio di maggiore importanza commerciale. Si trova in natura nei minerali valentinite e sénarmontite.
Indice
Sintesi
La maggior parte del Sb2O3 si ottiene per arrostimento della stibnite (Sb2S3).
La temperatura e la quantità di ossigeno vanno regolate attentamente per assicurare un'efficace volatilizzazione di Sb2O3 e nel contempo minimizzare l'ossidazione a ossido di antimonio(IV), Sb2O4. Una serie di condensatori all'uscita del forno separa Sb2O3 da impurità presenti che sono in genere Sb2O4 e PbO2 (meno volatili) e As2O3 (più volatile).
Alternativamente si può arrostire all'aria antimonio metallico; Sb2O3 sublima e viene raccolto per condensazione. Un altro metodo è per idrolisi in soluzione basica del tricloruro di antimonio. Le reazioni sono:
Reattività
Sb2O3 è un ossido anfotero, pressoché insolubile in acqua, ma solubile in acidi e basi. In acidi HX forti concentrati si scioglie formando sali di antimonile (SbOX) e sali SbX3. Ad esempio in acido cloridrico:
In soluzione basica di idrossido di sodio si scioglie formando antimoniti NaSb(OH)4 che possono essere disidratati a meta-antimoniti NaSbO2:
Sb2O3 può essere facilmente ridotto a metallo se riscaldato con carbone, idrogeno o monossido di carbonio. Con riducenti come il litio alluminio idruro si forma stibina, un gas instabile e molto tossico. Sb2O3 può anche essere ossidato a Sb2O4 per riscaldamento a 700-1000 °C in presenza di aria; trattato con acido nitrico si ossida a Sb2O5. Per riscaldamento con bitartrato di potassio si forma l'antimoniltartrato di potassio K2Sb2(C4H2O6)2 · 3H2O.
Struttura
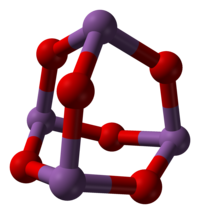
Sb2O3 esiste in varie modificazioni strutturali. Ad alta temperatura in fase gassosa è costituito da molecole di Sb4O6, che hanno una struttura simile all'analogo ossido del fosforo, P4O6 (vedi figura), con distanze Sb–O di 200 pm. La stessa struttura a gabbia si osserva a temperatura ambiente nel solido che cristallizza nel sistema cubico, con distanza Sb–O di 197,7 pm e angoli O–Sb–O di 95,6°. Questa forma esiste in natura nel minerale sénarmontite. Al di sopra di 606 °C diventa più stabile la forma ortorombica, che consiste di coppie di catene –Sb–O–Sb–O– dove gli atomi di antimonio sono legati da ponti ossigeno. Questa forma esiste in natura nel minerale valentinite.
Usi
Il consumo annuo di Sb2O3 negli Stati Uniti e in Europa è di circa 10.000 e 25.000 tonnellate rispettivamente. L'applicazione principale è come ritardante di fiamma in combinazione con composti alogenati, per impieghi su resine e polimeri utilizzati in apparecchiature elettriche, tessili, materie plastiche e rivestimenti in campo automobilistico. Tra gli altri usi principali è usato come opacizzante per vetrine in ceramica, nella fabbricazione di pigmenti, come catalizzatore nella produzione di poliesteri.
Tossicità / Indicazioni di sicurezza
Sb2O3 è disponibile in commercio. È un sospetto cancerogeno in base a esperimenti condotti su animali. È considerato poco pericoloso per l'ambiente acquatico.
Bibliografia
- (EN) J. M. Bellama e A. G. MacDiarmid, Synthesis of the Hydrides of Germanium, Phosphorus, Arsenic, and Antimony by the Solid-Phase Reaction of the Corresponding Oxide with Lithium Aluminum Hydride, in Inorg. Chem., vol. 7, n. 10, 1968, pp. 2070–2072, DOI:10.1021/ic50068a024.
- GESTIS, Antimony trioxide, su gestis-en.itrust.de. URL consultato il 20 dicembre 2015.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) S. C. Grund, K. Hanusch, H. J. Breunig e H. U. Wolf, Antimony and Antimony Compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a03_055.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) P. Patnaik, Handbook of inorganic chemicals, New York, McGraw-Hill, 2003, ISBN 0-07-049439-8.
- (EN) C. Svensson, Refinement of the crystal structure of cubic antimony(III) oxide, Sb2O3, in Acta Crystallographica, B31, 1975, pp. 2016–2018, DOI:10.1107/S0567740875006759.
- (EN) A. F. Wells, Structural Inorganic Chemistry, 5ª ed., Oxford University Press, 1984, ISBN 978-0-19-855370-0.
Altri progetti
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su Ossido di antimonio
Wikimedia Commons contiene immagini o altri file su Ossido di antimonio








