
Recettori accoppiati a proteine G
I recettori accoppiati alle proteine G (o GPCR) sono una famiglia di recettori biologici che comprende i recettori colinergici muscarinici, i recettori adrenergici, dopaminergici, serotoninergici, i recettori cannabinoidi e i recettori degli oppiacei e delle purine.
Indice
Struttura molecolare
I GPCR sono costituiti da una singola catena polipeptidica formata anche da 1100 residui. La caratteristica strutturale è rappresentata da 7 
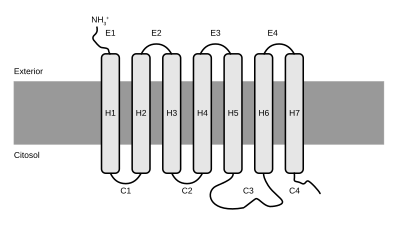
I GPCR vengono divisi in tre distinte famiglie che condividono la stessa struttura eptaelicale ma differiscono per vari aspetti, principalmente per la lunghezza della sequenza N-terminale e la localizzazione del sito di legame per l'agonista.
- La famiglia A, a cui appartiene la rodopsina, è di gran lunga la più numerosa e comprende la maggior parte dei recettori per le monoamine e i neuropeptidi.
- La famiglia B è costituita dai recettori della secretina, del glucagone e della calcitonina.
- La famiglia C è costituita principalmente dai recettori metabotropici del glutammato e dai recettori sensibili al
.
Il terzo lungo loop citoplasmatico dei recettori corrisponde alla regione della molecola che si accoppia alla proteina G. Modifiche di questa porzione della proteina determinano la formazione di recettori ancora in grado di legare i propri ligandi, ma incapaci di accoppiarsi alle proteine G e di determinare i conseguenti effetti.
Grazie al miglioramento delle tecnologie di cristallografia e NMR, molte strutture vennero via via risolte a partire dal 2000, consentendo la acquisizione di conoscenze più precise per lo structure-based drug design.
Trasduzione del segnale da parte dei GPCR
Attraverso l'attivazione di vari meccanismi di trasduzione del segnale, i GPCR controllano diversi aspetti della funzione cellulare. Il collegamento tra il recettore e il primo stadio della trasduzione del segnale viene stabilito attraverso le proteine G.
Le proteine G rappresentano il livello intermedio nella gerarchia organizzativa di gestione della comunicazione tra recettori ed enzimi effettori o canali ionici. Le proteine G eterotrimeriche consistono di tre subunità 







Allo stato di riposo, la proteina G si trova libera nella forma di trimero 









Ci sono differenze molecolari tra le varie proteine G: queste differenze danno origine a tre principali classi di proteine (




Bersagli per le proteine G
I principali bersagli delle proteine G, attraverso i quali i GPCR controllano diversi aspetti delle funzioni cellulari, sono i seguenti:
- adenilato ciclasi: l'enzima responsabile della formazione del cAMP;
- fosfolipasi C: l'enzima responsabile della formazione dell'inositolo trifosfato e del diacilglicerolo;
- canali ionici: in particolare i canali del calcio e del potassio.
Sistema dell'adenil ciclasi/AMPciclico
Il cAMP è un nucleotide sintetizzato all'interno della cellula a partire da ATP e con l'intervento di un enzima legato alla membrana, l'adenil ciclasi. Il cAMP viene prodotto continuamente e inattivato per idrolisi a 5'-AMP attraverso l'azione di una famiglia di enzimi noti come fosfodiesterasi. Molti farmaci, ormoni e neurotrasmettitori agiscono sui GPCR e producono i loro effetti aumentando o diminuendo l'azione catalitica dell'adenil ciclasi, determinando in tal modo un incremento o una riduzione della concentrazione intracellulare di cAMP.
Gli effetti regolatori del cAMP sulle funzioni cellulari sono molteplici e comprendono, ad esempio, enzimi coinvolti nel metabolismo energetico, nella divisione cellulare e nella differenziazione cellulare; il trasporto ionico; canali ionici e le proteine contrattili della muscolatura liscia. Tutti questi diversi effetti sono, però, provocati da un unico meccanismo, e precisamente l'attivazione di protein-chinasi da parte dell'cAMP. Le protein-chinasi determinano una regolazione funzionale di molte proteine cellulari attraverso la fosforilazione dei loro residui serinici e treoninici, utilizzando ATP come fonte di gruppi fosfato. La fosforilazione può attivare o inibire gli enzimi bersaglio o i canali ionici.
Esempi di regolazione da parte della protein-chinasi dipendente dall'cAMP includono l'aumento di attività dei canali del calcio attivati dal voltaggio nelle cellule muscolari cardiache; la fosforilazione di questi canali aumenta la quantità di calcio che entra nelle cellule durante il potenziale d'azione, incrementando in tal modo la forza di contrazione del cuore.
Nella muscolatura liscia, la protein-chinasi cAMP-dipendente fosforila, inattivandola, un'altra chinasi, la chinasi della catena leggera della miosina, che è necessaria per la contrazione. Questo spiega il rilassamento del muscolo liscio indotto da molti farmaci che aumentano la produzione di cAMP in questo sito.
Come è stato precedentemente detto, i recettori accoppiati a proteina 


Il cAMP viene idrolizzato, all'interno delle cellule, dalla fosfodiesterasi, un enzima che è inibito da farmaci come le metilxantine (ad esempio teofillina e caffeina). La somiglianza tra alcune delle azioni di questi farmaci e quelle delle catecolamine riflette probabilmente la loro proprietà comune di aumentare la concentrazione intracellulare di cAMP.
Il sistema fosfolipasi C/inositolo fosfato
Molti ormoni, oltre a promuovere l'aumento della concentrazione di calcio libero intracellulare (ad esempio gli agonisti muscarinici e gli agonisti [[







Fosfoinositoli e calcio intracellulare




Diacilglicerolo e protein-chinasi C
Il DAG e l'

Le varie isoforme di PKC agiscono su varie proteine funzionali come i canali ionici, i recettori, gli enzimi (tra cui altre chinasi) e alcune proteine del citoscheletro. Le chinasi, in generale, hanno un ruolo centrale nella trasduzione del segnale e controllano molti aspetti della funzione cellulare.
Canali ionici come bersaglio delle proteine G
I GPCR possono controllare l'attività funzionale di canali ionici direttamente, attraverso meccanismi che non implicano il coinvolgimento di secondi messaggeri come il cAMP e l'IP.
I recettori muscarinici del muscolo cardiaco aumentano la permeabilità al potassio (K), iperpolarizzando così le cellule e inibendo l'attività elettrica. Si ritiene che simili meccanismi operino anche nei neuroni, dove gli analgesici oppiacei riducono l'eccitabilità attraverso l'apertura dei canali del 


Voci correlate
Collegamenti esterni
- (EN) Recettori accoppiati a proteine G, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.