
Sibutramina
| Sibutramina | |
|---|---|
 | |
| Nome IUPAC | |
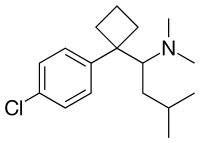
| (±)-1-(4-clorofenil)-N,N-dimetil-a-(2-metilpropil)- ciclobutan-metanamina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C17H26ClN |
| Numero CAS | 106650-56-0 |
| Numero EINECS | 600-761-4 |
| Codice ATC | A08AA10 |
| PubChem | 5210 |
| DrugBank | DB01105 |
| SMILES |
CC(C)CC(C1(CCC1)C2=CC=C(C=C2)Cl)N(C)C |
| Dati farmacocinetici | |
| Biodisponibilità | Riassorbimento 77% a causa dell'effetto di primo passaggio |
| Metabolismo | Epatico (mediato da CYP3A4) |
| Emivita | Sibutramina approssimativamente 1 ora Metabolita 1: 14 ore Metabolita 2: 16 ore |
| Escrezione | Biliare (sibutramina e metaboliti attivi), renale (metaboliti inattivi) |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | --- |
Sibutramina (commercializzata come Meridia negli USA, Leptos in India, Reductil in Europa e altrove), solitamente in forma di idrocloruro monoidrato, è un riduttore dell'appetito per via orale, usato nel trattamento dell'obesità. È un inibitore del reuptake della serotonina e della noradrenalina ma non della dopamina; strutturalmente è simile alle amfetamine anche se agisce diversamente.. Nel marzo 2002 il Ministero della Salute ne decretò la sospensione dal commercio a seguito di una revisione dei dati di sicurezza, che rivelarono l'esistenza di un rischio cardiovascolare correlato al suo utilizzo.. Contemporaneamente l'Italia avviò una procedura di arbitrato a livello europeo richiedendo un parere al Comitato tecnico-scientifico dell'Agenzia europea per i medicinali. L'agenzia europea diede parere favorevole al mantenimento in commercio del farmaco, pertanto ad agosto dello stesso anno la sibutramina fu riammessa, con l'obbligo tuttavia di presentare ricetta medica specialistica per l'acquisto e di consegna al paziente di una scheda informativa sui possibili rischi.. L'agenzia europea aveva tuttavia richiesto all'azienda produttrice del farmaco uno studio multicentrico che valutasse l'efficacia e la sicurezza del farmaco. Lo studio richiesto venne denominato SCOUT (Sibutramine Cardiovascular OUTcome) e i risultati, pubblicati nel 2009, rivelarono che:
- la perdita di peso ottenuta con la sibutramina è modesta
- tale perdita di peso non si mantiene dopo la fine del trattamento
- i pazienti trattati con sibutramina avevano un aumento del rischio cardiovascolare del 16% rispetto ai pazienti trattati con placebo.
Il 24 gennaio 2010 pertanto, la sibutramina venne nuovamente sospesa dalla commercializzazione.
La casa farmaceutica produttrice ha dichiarato di voler fare appello contro questa decisione.
Avvertenze
Sicurezza: a seguito di una rivalutazione della sicurezza e dell'efficacia della sibutramina, il Comitato dell’Agenzia dei Medicinali per uso Umano (CHMP), ha concluso che i benefici della sibutramina non superano i potenziali rischi, pertanto ha deciso di sospendere tutte le autorizzazioni alla immissione in commercio dei medicinali contenenti sibutramina nell'Unione europea. La sibutramina era già stata oggetto di una rivalutazione da parte dell'EMEA in seguito alla segnalazione di effetti collaterali cardiovascolari (aumento della pressione arteriosa e della frequenza cardiaca), ma in quell'occasione, il comitato responsabile dell'Agenzia regolatoria non aveva ritenuto di dover modificare il proprio parere sul profilo di sicurezza del farmaco, ma in attesa aveva chiesto ulteriori dati clinici alla ditta produttrice. Lo studio SCOUT che ne è conseguito ha arruolato più di 9000 pazienti in sovrappeso e obesi ad alto rischio di malattie cardiovascolari ed ha verificato, in questo tipo di popolazione, gli effetti di sibutramina vs placebo, per quanto riguarda l'entità della perdita di peso ed il verificarsi di eventi cardiovascolari. I dati preliminari dello studi hanno confermato un maggior rischio di problemi cardiovascolari nei pazienti in trattamento con sibutramina rispetto ai controlli (incidenza degli eventi cardiovascolari: 6,5% vs 6,5%, rispettivamente con placebo e sibutramina, nei pazienti con diabete di tipo 2 (tasso di rischio pari a 1,010 CI 95% 0,737-1,383); 8,3% vs 10,1% nei pazienti con storia di patologie cardiovascolari (tasso di rischio 1,274 CI 95% 0,915-1,774); 11,9% vs 13,9% (tasso di rischio 1,182 CI 95% 1,024-1,354) (FDA, 2010). Sebbene la sibutramina sia controindicata nei pazienti con patologia cardiovascolare nota, l'EMEA ha ritenuto che l'aumento del rischio cardiovascolare associato a sovrappeso e obesità, in assenza di malattia cardiovascolare nota, sia “eccessivo“ per un uso sufficientemente “sicuro“ del farmaco, rispetto anche alla perdita di peso ottenuta. La sospensione all'autorizzazione in commercio della sibutramina stabilita dall'EMEA resterà in vigore finché non verrà identificato un gruppo di pazienti per i quali i benefici di sibutramina sono chiaramente superiori ai rischi. L'FDA ha ritirato dal commercio la sibutramina a seguito del rischio aumentato di eventi cardiovascolari avversi.
Altri progetti
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su Sibutramina
Wikimedia Commons contiene immagini o altri file su Sibutramina
Collegamenti esterni
- (EN) Effetti collaterali, su rxlist.com. URL consultato il 9 settembre 2008 (archiviato dall'url originale il 9 agosto 2008).