
Uranile


Lo ione uranile è un catione poliatomico di formula [UO2]2+.
È una specie chimica ben caratterizzata, ha una struttura lineare con legami U–O corti, indice della presenza di legami multipli tra uranio e ossigeno. Lo stato di ossidazione dell'uranio è +6. I composti che contengono lo ione uranile sono in genere di colore giallo. Lo ione uranile può formare molti complessi, specie con leganti che utilizzano atomi donatori di ossigeno. I complessi dello ione uranile sono importanti nell'estrazione dell'uranio dai suoi minerali e nel riprocessamento del combustibile nucleare.
Indice
Struttura e legami
Lo ione uranile è lineare con simmetria D∞h, con distanze U–O di circa 180 pm. Queste distanze di legame indicano la presenza di un legame multiplo tra gli atomi di uranio e ossigeno. L'uranio nello stato di ossidazione +6 ha configurazione elettronica [Rn], e quindi gli elettroni usati per formare i legami provengono dagli atomi di ossigeno. In genere si considera che i tre orbitali p dell'ossigeno si combinino con gli orbitali 6d e 5f dell'uranio in modo da fornire un legame σ e due legami π. Ne risultano tre legami fra U ed O, come da figura.
Lo ione uranile è sempre accompagnato ad una componente anionica, che in forma solida si dispone nel piano equatoriale della molecola (cioè quello perpendicolare all'asse O–U–O e passante per l'atomo di uranio).
I leganti aggiuntivi possono essere quattro, cinque o sei; ne risultano rispettivamente strutture ottaedriche, a bipiramide pentagonale, e a bipiramide esagonale.
Spettroscopia
I composti che contengono lo ione uranile sono in genere di colore giallo, ma possono essere anche di colore rosso, arancio e verde. In quelli gialli il colore è dovuto ad una banda a trasferimento di carica LMCT a circa 420 nm, all'estremità blu dello spettro visibile. La posizione esatta della banda di assorbimento e delle bande XANES dipende dalla natura dei leganti equatoriali.
Lo ione uranile è luminescente, con una banda di emissione nell'intervallo 450-650 nm. Il primo studio sulla luminescenza verde del vetro all'uranio fu condotto da David Brewster nel 1849. In seguito sono stati condotti numerosissimi studi e si è stabilito che la luminescenza è classificabile come fosforescenza, dato che è originata dalla transizione dal più basso stato eccitato di tripletto allo stato fondamentale di singoletto. La luminescenza di K2UO2(SO4)2 è implicata nella scoperta della radioattività.
Lo ione uranile ha frequenze di stiramento caratteristiche a circa 880 cm−1 (spettro Raman) e circa 950 cm−1 (spettro IR). Le frequenze sono un po' influenzate dalla natura dei leganti presenti nel piano equatoriale. Le frequenze di stiramento sono correlate con la distanza di legame U–O. Si è anche osservato che le frequenze di stiramento sono correlate con la posizione dei leganti equatoriali nella serie spettrochimica.
Reattività
Lo ione uranile in acqua è stabile e mantiene la sua identità in molte reazioni, ma la sua chimica è complicata per la simultanea presenza di reazioni di complessazione e di idrolisi. La specie predominante è quella con cinque molecole d'acqua coordinate; esiste anche una piccola percentuale di ioni uranile coordinati a quattro molecole d'acqua. Soluzioni dello ione uranile in acqua sono acide a causa dell'idrolisi. Gli equilibri di idrolisi sono piuttosto complicati, con formazione di specie anche polimeriche, e sono influenzati dal pH e dalla presenza di altri ioni; le specie più importanti sono [UO2OH]+, [(UO2)2(OH)2]2+ e [(UO2)3(OH)5]+.
Lo ione uranile è abbastanza resistente alla riduzione, ma può essere ridotto a U4+ con Cr2+, e a U3+ con amalgama di zinco o per via elettrolitica. Sia U4+ che U3+ in presenza di aria sono riossidati a [UO2]2+. La corrispondente specie di U(V), [UO2]+ è invece molto instabile e dà luogo a dismutazione.
Per irradiazione con luce visibile si forma lo stato eccitato *[UO2]2+ che è luminescente ed è un ossidante molto forte (E° = 2,6 V).
Complessi
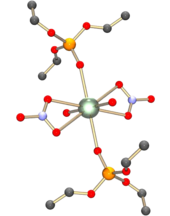
Lo ione uranile si comporta da acido hard e quindi forma complessi più stabili con lo ione fluoruro e leganti con atomi donatori di ossigeno, come gli ioni idrossido, nitrato, solfato e carbossilato. Anche molecole neutre come acqua e fosfinossidi possono legarsi in modo analogo. Il complesso formato può contenere quattro, cinque o sei atomi coordinati nel piano equatoriale. Ad esempio il nitrato di uranile, [UO2(NO3)2]•2H2O, contiene sei atomi coordinati nel piano equatoriale: quattro dai leganti nitrato legati in modo bidentato, e due dalle due molecole di acqua. L'atomo di uranio risulta così al centro di una struttura a bipiramide esagonale, simile a quella illustrata a fianco per UO2(NO3)2•2OP(OC2H5).
Presenza in natura
A riprova della stabilità dello ione [UO2]2+, lo si trova in natura in molti minerali. Alcuni esempi sono:
- Carnotite K2(UO2)2V2O8·3(H2O)
- Autunite Ca(UO2)2(PO4)2·10-12(H2O)
- Torbernite Cu(UO2)2(PO4)2·8-12(H2O)
- Uranofano Ca(UO2)2(SiO3OH)2·5H2O
- Coffinite U(SiO4)1-x(OH)4x
Questi minerali sono di scarsa importanza commerciale; la maggior parte dell'uranio viene estratta dalla pechblenda, che è sostanzialmente UO2 contaminata da UO3 e ossidi di altri elementi.
Usi
Il nitrato di uranile, UO2(NO3)2, è importante nei processi di purificazione dell'uranio perché può essere estratto in solventi non polari a partire da soluzioni di acido nitrico.
L'ossalato di uranile era usato come attinometro prima dell'introduzione del ferriossalato di potassio.
Sali di uranile sono usati per colorare campioni per studi di microscopia elettronica sul DNA.
Tossicologia
I sali di uranile sono tossici e possono causare grave insufficienza renale e necrosi tubulare acuta. Tra gli organi bersaglio ci sono reni, fegato, polmoni e cervello. Accumulo di ioni uranile nei gonociti provoca malattie congenite, e nei globuli bianchi del sangue provoca danni al sistema immunitario. I composti contenenti uranile sono anche neurotossine. Contaminazione da ioni uranile è stata rilevata nei pressi di bersagli colpiti con uranio impoverito.
Tutti i composti di uranio sono radioattivi. Tuttavia l'uranio in genere è disponibile nella forma impoverita, tranne che nell'ambito dell'industria nucleare. L'uranio impoverito è costituito principalmente da 238U che decade con un tempo di dimezzamento di 4,47 × 109 anni. Dato che emette deboli radiazioni alfa, la sua radioattività è pericolosa solo per contatto diretto o per ingestione.
Bibliografia
- D. P. Arfsten, K. R. Still e G. D. Ritchie, A review of the effects of uranium and depleted uranium exposure on reproduction and fetal development, in Toxicol. Ind. Health, vol. 17, 5–10, 2001, pp. 180–191, DOI:10.1191/0748233701th111oa.
- V. Balzani e V. Carassiti, Photochemistry of coordination compounds, Londra, Academic Press, 1970, ISBN 0-12-077250-7.
- S. Berto, F. Crea, P. G. Daniele, C. de Stefano, E. Prenesti e S. Sammartano, Dioxouranium(VI) – Carboxylate Complexes. Interaction with Dicarboxylic Acids in Alqueous Solution: Speciation and Structure, in Ann. Chim., vol. 96, n. 78, 2006, p. 399420, DOI:10.1002/adic.200690042.
- D. Brewster, Trans. R. Soc. Edinburgh, vol. 6, 1849, pp. 111–121.
- F. A. Cotton, G. Wilkinson, C. A. Murillo e M. Bochmann, Advanced Inorganic Chemistry, 6ª ed., Wiley-Interscience, 1999, ISBN 978-0-471-19957-1.
- C. Fillaux, D. Guillaumont, J.-C. Berthet, R. Copping, D. K. Shuh, T. Tyliszczak e C. Den Auwer, Investigating the electronic structure and bonding in uranyl compounds by combining NEXAFS spectroscopy and quantum chemistry, in Phys. Chem. Chem. Phys., vol. 12, 2010, pp. 14253–14262, DOI:10.1039/C0CP00386G.
- N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- D. Hagberg, G. Karlström, B. O. Roos e L. Gagliardi, The Coordination of Uranyl in Water: A Combined Quantum Chemical and Molecular Simulation Study, in J. Am. Chem. Soc., vol. 127, n. 41, 2005, pp. 14250–14256, DOI:10.1021/ja0526719.
- M. Montalti, A. Credi, L. Prodi, M. T. Gandolfi, Handbook of photochemistry, 3ª ed., Boca Raton, CRC Press, 2006, ISBN 0-8247-2377-5.
-
K. Nakamoto, Infrared and Raman spectra of Inorganic and Coordination compounds, Parte A, 5ª ed., Wiley, 1997, ISBN 0-471-16394-5. Parte B, ISBN 0-471-16392-9. Parametro
titolovuoto o mancante (aiuto) - B. Salbu, K. Janssens, O.C. Lind, K. Proost, L. Gijsels e P.R. Danesi, Oxidation states of uranium in depleted uranium particles from Kuwait, in J. Environ. Radioactivity, vol. 78, n. 2, 2004, pp. 125–135, DOI:10.1016/j.jenvrad.2004.04.001.
- H. Schröder, A. Heimers, R. Frentzel-Beyme, A. Schott e W. Hoffman, Chromosome Aberration Analysis in Peripheral Lymphocytes of Gulf War and Balkans War Veterans (PDF), in Radiation Protection Dosimetry, vol. 103, n. 3, 2003, pp. 211–219. URL consultato il 5 marzo 2012 (archiviato dall'url originale l'8 gennaio 2014).
- D. S. Umreiko, Symmetry in the electronic absorption spectra of uranyl compounds, in J. Appl. Spectrosc., vol. 2, n. 5, 1965, pp. 302–304, DOI:10.1007/BF00656800.
- C. R. Zobel e M. Beer, Electron Stains I. Chemical Studies on the Interaction of DNA with Uranyl Salts, in J. Cell Biol., vol. 10, n. 3, 1961, pp. 335–346, DOI:10.1083/jcb.10.3.335. URL consultato il 2 marzo 2012.
Altri progetti
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su Uranile
Wikimedia Commons contiene immagini o altri file su Uranile
Collegamenti esterni
- (EN) Uranile, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.