
Virus del papilloma umano
| Virus del papilloma umano | |
|---|---|
 | |
| Classificazione scientifica | |
| Dominio | Monodnaviria |
| Regno | Shotokuvirae |
| Phylum | Cossaviricota |
| Classe | Papovaviricetes |
| Ordine | Zurhausenvirales |
| Famiglia | Papillomaviridae |
I virus del papilloma umano (HPV, acronimo di human papillomavirus) sono un insieme di virus a dsDNA appartenenti alla famiglia Papillomaviridae. Le infezioni da HPV sono estremamente diffuse nella popolazione e sono trasmesse prevalentemente per via sessuale.
Solitamente l'infezione provocata da questi virus non causa nessuna alterazione e si risolve da sola. Se l'infezione si prolunga nel tempo allora possono insorgere malattie della cute e delle mucose. Un esempio è la lesione mucosa a livello del collo dell'utero. La maggior parte di queste lesioni cervicali guarisce spontaneamente, ma alcune, se non trattate, progrediscono lentamente verso forme tumorali.
Indice
Classificazione
Nei campioni biologici umani sono stati individuati più di 100 genotipi di HPV differenti. Solitamente due genotipi differenti presentano anche caratteristiche antigeniche diverse. Alcuni genotipi sono associati a lesioni specifiche, altri invece vengono riuniti in gruppi ad alto o a basso rischio in base alle loro capacità cancerogene.
È inoltre possibile distinguere i papillomavirus in cutanei e mucosi a seconda del tessuto per cui manifestano maggiore tropismo.
La maggior parte dei virus di questa famiglia rimane asintomatico o causa patologie non gravi, quali ad esempio le verruche cutanee; tuttavia alcuni genotipi possono causare lesioni iperplastiche come i condilomi e altri ancora causano lesioni che possono esitare in tumori maligni come il cancro al collo dell'utero, al cavo orale, all'ano, all'esofago e alla laringe.
Struttura
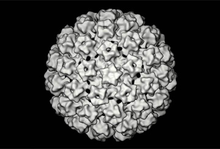
Gli HPV sono virus nudi (senza pericapside), possiedono un capside icosaedrico con un diametro attorno ai 50 nm, formato da 72 capsomeri che possono essere pentameri o esameri (60 esameri e 12 pentameri). Ciascun capsomero dà origine a una protuberanza che ha una forma simile a una stella a cinque punte con un canale al centro. Il capside contiene un genoma costituito da DNA circolare a doppio filamento lungo 8 kb che codifica per sei geni precoci (early, da E1 a E7; N.B. non c'è E3) e due geni tardivi (late, L1 e L2). A monte dei geni precoci c'è una regione regolatrice contenente l'origine della replicazione, alcune sequenze regolanti la trascrizione e una sequenza N-terminale comune a tutte le proteine precoci. Le proteine precoci servono a modificare il metabolismo della cellula infettata per metterlo al servizio dell'HPV, mentre le tardive sono le proteine strutturali, che associandosi tra loro formano la struttura icosaedrica del capside virale. Tutti i geni di HPV sono collocati sul filamento positivo.
Proteine virali
Il DNA di HPV codifica per proteine precoci (early, nomenclate con la lettera E seguita da un numero) e tardive (late, nomenclate con la lettera L, seguita da un numero). Le funzioni di queste proteine sono:
- La proteina L1 - Proteina capsidica maggiore (codifica per componenti del capside);
- La proteina L2 - Proteina capsidica minore (codifica per componenti del capside);
- La proteina E1 consente la replicazione episomale, con attività di elicasi;
- La proteina E2 partecipa alla trascrizione del promoter di E6, attiva E1 e possiede capacità transattivatrice. In particolare la trascrizione di E2 inibisce E6 ed E7; quando il DNA di HPV si integra con il genoma umano si ha la rottura delle sequenze geniche di E2, con soppressione dell'inibizione nei confronti di E6 ed E7;
- La proteina E4 è espressa nelle fasi tardive dell'infezione ed è molto importante nella maturazione e proliferazione virale. È in grado di legarsi alle proteine citoscheletriche, provocando la deformazione delle cellule infettate (coilocitosi);
- La proteina E5 blocca l'esposizione dei complessi di istocompatibilità di tipo I e II, evitando la risposta cellulare T mediata e inoltre inibisce l'apoptosi e altera i segnali promossi dal legame di EGF e di PDGF con i rispettivi recettori
- La proteina E6 si lega a p53, interferendo con la riparazione del DNA e con l'innesco dell'apoptosi;
- La proteina E7 si lega alla proteina del retinoblastoma (Rb), impedendo il blocco del ciclo cellulare.

Proteine oncogene
In virtù delle loro proprietà leganti e inattivanti oncosoppressori come p53 e Rb, le proteine codificate dal genoma virale promuovono un'intensa replicazione cellulare che esita verso la formazione di papillomi, condilomi acuminati, iperplasia epiteliale focale, verruche e carcinomi. Tuttavia, non tutti i Papilloma Virus sono responsabili di forme cancerose. In particolare, i carcinomi della cervice uterina sono innescati dai genotipi 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, benché i tipi 16 e 18 siano i più frequenti, mentre le verruche e condilomi semplici sono generati dai genotipi 2, 7 (verruche comuni), 1, 2, 4 (verruche plantari) e 3, 10 (verruche piane).
Proteine immunogeniche
L'oncoproteina E7 è una piccola proteina idrosolubile costituita soltanto da 98 amminoacidi, scarsamente immunogenica. Per questo, non può essere usata singolarmente come aptene e deve essere "fusa" con complessi proteici più immunogenici. La stimolazione di una risposta immunitaria polarizzata da un vaccino contenente frammenti o proteine complessate con E6 ed E7 può essere in grado di eliminare il rischio di cancro connesso con l'infezione da HPV.
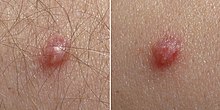
Le infezioni da HPV
Gli HPV si contraggono tramite contatto diretto (sessuale, orale e cutaneo) o in luoghi poco puliti (ad esempio bagni pubblici non disinfettati a norma). Sono presenti in liquidi biologici quali saliva, sperma o sangue, sebbene non sia chiaro se e come sia possibile infettarsi tramite questi fluidi. Il rischio di contrarre una infezione da HPV aumenta con il numero dei partner sessuali, ed è massimo tra i giovani adulti (20-35 anni). Il virus è più frequentemente trovato tra le popolazioni promiscue e in condizioni precarie di igiene. L'uso del profilattico non pare avere azione protettiva completa in quanto l'infezione è spesso diffusa anche alla cute della vulva e del perineo.
L'infezione da HPV è asintomatica nella maggior parte dei casi. In alcuni casi, si può invece manifestare con condilomi acuminati in sede genitale (pene e vulva, perineo). Le lesioni da HPV del collo uterino possono essere riconosciute mediante il Pap test, la colposcopia o tecniche di patologia molecolare, e le lesioni del pene mediante la penescopia. I condilomi, generalmente provocati dal virus HPV, sono delle escrescenze della pelle di tipo verrucoso che colpiscono di preferenza le zone genitali, sia nel maschio (glande, meno frequentemente sotto il prepuzio, corpo del pene e scroto) sia nella femmina (perineo, vulva, vagina e cervice uterina).
Ogni anno, in Italia, sono circa 3.500 le donne che si ammalano di cancro del collo dell'utero. Si stima che il 75% della popolazione entri in contatto con il virus almeno una volta durante la sua vita. Si calcola che oltre il 70% delle donne contragga un'infezione genitale da HPV nel corso della propria vita, ma la grande maggioranza di queste infezioni è destinata a scomparire spontaneamente nel corso di pochi mesi grazie al loro sistema immunitario. Solo in caso di persistenza nel tempo di infezioni di HPV ad alto rischio oncogenico è possibile, in una minoranza dei casi e nel corso di parecchi anni, lo sviluppo di un tumore maligno del collo uterino.
Patogenesi
Le proteine precoci del virus hanno lo scopo di favorire la crescita e la divisione della cellula; l'HPV può infatti replicare solo nelle cellule in replicazione, in quanto non codifica per una sua DNA polimerasi e ha bisogno della polimerasi della cellula ospite, che viene sintetizzata nelle cellule in attiva divisione.
Le cellule bersaglio del virus sono la cute e le mucose, due tessuti che si rigenerano in continuazione. Il virus induce la crescita degli strati basale e spinoso dell'epidermide (acantosi) o dello strato superficiale della mucosa, dando origine, a seconda del luogo dell'infezione, a verruche nella cute o a papillomi nelle mucose; promuove inoltre la sintesi delle cheratine (ipercheratosi).
L'espressione dei geni di HPV è correlata con le diverse tipologie di cheratina espresse negli strati dell'epidermide. Lo strato basale e quello spinoso dell'epidermide contengono all'interno del nucleo delle loro cellule anche il DNA virale dell'HPV, mentre i geni tardivi L1 e L2 che permettono la formazione del virione maturo sono espressi solo nello strato corneo dell'epidermide. La replicazione del virus avviene preferenzialmente nello strato granuloso. Il virus viene liberato insieme ai cheratinociti morti degli strati più superficiali dell'epidermide.
Una volta che l'HPV è entrato dentro la cellula ne sfrutta i macchinari cellulari per sintetizzare due proteine chiamate E6 e E7, che legano rispettivamente p53 (mediandone la degradazione e prevenendo così l'apoptosi) e la RB protein (una proteina coinvolta nella regolazione del ciclo cellulare). Questo causa divisioni cellulari incontrollate. Si pensa che questi cambiamenti fisiologici nelle cellule infettate servano al virus per diffondersi meglio.
I tipi pericolosi di HPV (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68) si differenziano da quelli innocui (6, 11, 42, 43, 44) sia in base al sito di azione (i primi attaccano le mucose e i secondi la cute) sia in base ad alcune mutazioni dell'oncoproteina E7 (early 7). Questa differente pericolosità è dovuta al fatto che le mucose sono molto più sensibili della pelle alle infezioni di HPV perché la minore robustezza delle membrane cellulari delle cellule delle mucose facilita l'ingresso dei virus all'interno delle stesse, e in più le oncoproteine E7 dei Papilloma Virus pericolosi hanno delle mutazioni amminoacidiche che permettono un legame e un'inibizione migliore del retinoblastoma rispetto agli E7 dei tipi non pericolosi. Per esempio la differenza amminoacidica principale tra l'E7 dell'HPV 16 (pericoloso) e 6 (non pericoloso) è un acido aspartico in posizione 21 presente nel primo invece di una glicina presente nel secondo; questa sola differenza fa sì che la prima proteina abbia una capacità ligante (e quindi di causare il cancro) del 41% superiore alla seconda.
Infezione da HPV e gravidanza
È possibile che una donna contragga l'infezione da HPV in gravidanza, con conseguente preoccupazione circa l'andamento dell'infezione e la trasmissione al feto. Il rischio di contrarre l'infezione in gravidanza non è diverso rispetto alla non-gravidanza, e la distribuzione dei tipi virali ad alto e basso rischio non presenta differenze. L'infezione può tuttavia comparire la prima volta in gravidanza e dare origine a lesioni genitali che possono assumere aspetti aberranti, molto estese, giganti e friabili.
Nonostante la trasmissione materno fetale sia possibile a livello del canale del parto e possa provocare papillomatosi respiratoria ricorrente giovanile e condilomatosi genitale nel nato, il parto cesareo non è indicato, a meno di lesioni molto estese che ostruiscano il canale del parto.
Diagnosi
La diagnosi dell'infezione di HPV ad alto rischio viene eseguita mediante una classe di test molecolari denominati HPV DNA Test. Questi test sono sempre più diffusi a livello mondiale; il Gruppo Italiano Screening del Cervicocarcinoma (GISCI) riporta:
"La ricerca scientifica ha dimostrato che il test HPV è più efficace del Pap test per la prevenzione del cervicocarcinoma, in Italia sono stati avviati i primi programmi di screening con test HPV, un esame molecolare di laboratorio che consente di individuare la presenza del virus prima che provochi alterazioni nelle cellule. Il test HPV per essere efficace deve essere fatto all’interno di un programma organizzato che garantisce protocolli e controlli di qualità adeguati. In questo nuovo programma il Pap test non scompare ma diventa un esame di completamento (Pap test di triage) che viene letto solo nelle donne risultate positive al test HPV."
Esistono quasi duecento HPV DNA Test in commercio, la maggior parte dei quali si basa sull'analisi di cellule prelevate dal tessuto della cervice uterina effettuato mediante strumenti simili a quelli utilizzati per l'esecuzione del Pap test, come la spatola di Ayre. Molti dei test molecolari sono in grado di rilevare la presenza o assenza dei genotipi dei principali Papillomavirus ad alto rischio, senza specificarne il genotipo. Altri test, denominati test di genotipizzazione dell'HPV, sono in grado di fornire informazioni sul ceppo presente nell'infezione, anche in caso di infezione multipla. Recenti studi hanno dimostrato che genotipi diversi di questo oncovirus hanno un diverso potenziale di trasformazione tumorale (cancerogenesi), e ciò potrebbe essere utile in fase di triage e follow-up.
In Italia, nel 2019, è stato validato clinicamente un test molecolare altamente sensibile, basato sull'auto-prelievo del solo muco vaginale, caratteristica che rende il test non invasivo, indolore e semplice da eseguire. Inoltre il test è in grado di fornire indicazioni sul genotipo presente nel campione biologico e non richiede l'estrazione del DNA. L'auto-prelievo di muco vaginale può essere effettuato dalla donna direttamente a casa senza ulteriori procedure mediche. Il campione auto-prelevato viene poi inviato ed analizzato presso il Policlinico dell'Università Campus Bio-medico di Roma. Il referto medico viene consegnato alla donna mediante una piattaforma digitale accessibile da smartphone o computer. Il test è stato sviluppato dalla start-up "Ulisse Biomed" di Trieste, fondata da Rudy Ippodrino e Bruna Marini, due ricercatori perfezionatisi alla Normale di Pisa. A seguito dei risultati incoraggianti della ricerca, era stato previsto il lancio del test entro l'autunno del 2019.
Terapia
Come in molte infezioni virali, la terapia dell'infezione da HPV è spesso problematica. Poiché tuttavia la maggior parte delle infezioni da HPV regredisce spontaneamente, solo una minoranza dei casi richiederà un trattamento. Nei casi di infezione persistente del collo uterino, non esistono attualmente trattamenti non invasivi di elevata efficacia. Nel caso l'infezione sia associata a modificazioni precancerose dell'epitelio, possono essere prese in considerazione la laserterapia o la conizzazione, ossia la resezione di una piccola parte della cervice uterina per asportare una lesione che potrebbe essere maligna o che già lo è, ma di dimensioni ridotte. Per la rimozione dei condilomi acuminati della vulva, pene o perineo si può ricorrere al laser, all'elettrocoagulazione, alla crioterapia o ad applicazioni di podofillina.
Bibliografia
- Patrick R. Murray, Microbiologia medica, Roma, EMSI, 2008, ISBN 978-88-86669-56-6.
- Gianni Bonadonna, Gioacchino Robustelli Della Cuna, Pinuccia Valgussa, Medicina oncologica, 8ª ed., Milano, Elsevier Masson, 2007, ISBN 978-88-214-2814-2.
- Patrizia Marini, http://www.microbiology5.org/microbiology5/book/757-766.pdf.
Voci correlate
- Biopsia
- Cervarix
- Cidofovir
- Citologia
- Colposcopia
- Epidermodisplasia verruciforme
- Gardasil
- Papilloma
- Pap test
- Peniscopia
Altri progetti
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su virus del papilloma umano
Wikimedia Commons contiene immagini o altri file su virus del papilloma umano
Collegamenti esterni
- (EN) Virus del papilloma umano, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 5361 · LCCN (EN) sh85097679 · BNF (FR) cb120821523 (data) · J9U (EN, HE) 987007563274305171 |
|---|