
Acido ascorbico
| Acido ascorbico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 5R-(1S,2-diidrossietil)-3,4-diidrossifuran-2(5H)-one | |
| Nomi alternativi | |
| Vitamina C | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C6H8O6 |
| Massa molecolare (u) | 176,12 |
| Aspetto | solido giallo o bianco |
| Numero EINECS | 200-066-2 |
| DrugBank | DB00126 |
| Proprietà chimico-fisiche | |
| Densità (g/l, in c.s.) | 1650 |
| Costante di dissociazione acida (pKa) a 298,15 K | 4,17 (prima dissociazione) 11,6 (seconda dissociazione) |
| Solubilità in acqua | 330 g/L |
| Temperatura di fusione | 190–192 °C (463–465 K) con decomposizione |
| Indicazioni di sicurezza | |
| Frasi H | nessuna |
| Consigli P | nessuna |
L'acido L-ascorbico, o semplicemente acido ascorbico (noto anche come principio antiscorbutico e vitamina C) è un composto organico con proprietà antiossidanti presente in natura; mentre nel metabolismo della gran parte dei mammiferi questo principio viene sintetizzato autonomamente, l'uomo ha bisogno di assumerlo attraverso l'alimentazione.
Secondo la teoria dei vitameri, esso è il principale vitamero della vitamina C; secondo la teoria dei complessi biologici vitaminici, invece, l'acido ascorbico è soltanto uno dei componenti e dei co-fattori del complesso vitaminico C, in particolare ne è "l'involucro antiossidante", che «protegge le parti funzionali della vitamina da ossidazione rapida o decadimento». (Somer p 58 “Vitamin C: A Lesson in Keeping An Open Mind” The Nutrition Report)
È un solido bianco che può apparire giallastro in campioni impuri, inumiditi, oppure ossidati dall'ossigeno atmosferico. Si tratta anche di una vitamina idrosolubile, essenziale nell'uomo a differenza di altri mammiferi, in cui è sintetizzata dall'organismo, spesso utilizzata in forma salina (ascorbato) dove svolge molteplici funzioni.
Indice
Storia
La sua storia si riallaccia a quella dello scorbuto, una patologia legata a una carenza di questo composto nella dieta. Questa malattia era già descritta nella medicina greca attorno al V secolo a.C. Nel XVI secolo, soprattutto tra le popolazioni marinare, era noto come lo scorbuto potesse essere curato e prevenuto dall'assunzione di verdure e frutta fresca, o dall'estratto di aghi di pino.
Tuttavia la prima prova di ciò venne nel maggio del 1747 da parte di James Lind, un chirurgo della marina reale inglese. Lind sottopose a un esperimento 12 membri dell'equipaggio affetti da scorbuto, dividendoli in sei gruppi da due persone ciascuno. A ogni gruppo fece assumere, oltre alle normali razioni alimentari, un composto particolare: sidro, acido solforico, aceto, spezie ed erbe, acqua di mare, arance e limoni. I risultati ottenuti permisero di dimostrare che effettivamente quest'ultima aggiunta permetteva di prevenire l'insorgere dello scorbuto. Lind pubblicò i risultati di questo studio nel 1753. Nel 1795 la marina inglese stabilì di aggiungere succo di limone o di lime alla dieta dei marinai.
Nel XVIII e XIX secolo venne usato il termine di antiscorbutico per tutti quei cibi che erano in grado di prevenire la comparsa dello scorbuto. Tra essi, oltre ai limoni, alle arance e ai lime, vi sono: i crauti, il cavolo salato, il malto e il brodo portatile. Pare che James Cook per il suo primo famoso viaggio d'esplorazione nel Pacifico abbia utilizzato i crauti.
Nel 1912 Casimir Funk, da studi su malattie carenziali, ipotizzò la presenza di composti che denominò vitamine. Sebbene avesse studiato soprattutto il beri-beri, ipotizzò che anche altre malattie, tra cui lo scorbuto, dipendessero da mancanza di specifiche vitamine.
Nel 1921 il composto antiscorbutico venne denominato vitamina C e tra il 1928 e 1933 fu isolato e cristallizzato da Joseph Svirbely e dall'ungherese Albert Szent-Gyorgyi Von Nagyrapolt e, in modo indipendente, da Charles Glen King. Nel 1934 Sir Walter Norman Haworth e Tadeusz Reichstein, in maniera indipendente, riuscirono a sintetizzare la vitamina C. Nel 1937 Szent-Gyorgyi ricevette il Premio Nobel per la medicina per le sue scoperte sui processi biologici di combustione, con particolare riguardo alla vitamina C, e alla catalisi dell'acido fumarico. Lo stesso anno Haworth venne insignito del Premio Nobel per la chimica.
Nel 1955 J.J. Burns scoprì che il motivo per cui alcuni mammiferi, compresa la specie umana, non riescono a produrre autonomamente la vitamina C risiede nella mancanza dell'ultimo enzima della catena metabolica responsabile della sintesi di tale molecola: la L-gulonolattone ossidasi.
Caratteristiche chimiche
L'acido ascorbico esiste in due forme enantiomere (immagini speculari non sovrapponibili tra loro), ma solo una di esse, l'enantiomero (5R)-5-[(1S)-1,2-diidrossietil]-3,4-diidrossifurano-2(5H)-one, è la vitamina C.
È un composto molto idrosolubile, debolmente acido, che si presenta sotto forma di cristalli inodori di sapore acido , con una rotazione ottica specifica di circa +20 gradi.
La vitamina C assunta con la dieta viene assorbita a partire dalla bocca, nello stomaco e soprattutto a livello dell'intestino tenue grazie a un processo di diffusione passiva dipendente dal sodio. Questo sistema è molto efficiente soprattutto per basse dosi della vitamina. Via via che la concentrazione di acido ascorbico cresce, il sistema di assorbimento si riduce di efficienza fino al 16%. Nel plasma la vitamina circola per il 90-95% come acido ascorbico e nel 5-10% come acido deidroascorbico. La vitamina C viene immagazzinata nei tessuti dell'organismo, in particolare nel surrene e nel fegato. La quota plasmatica che non viene immagazzinata viene eliminata con le urine.

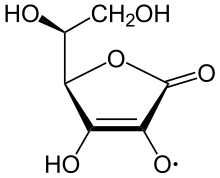

La vitamina C possiede una forte azione riducente a seguito della presenza di un gruppo enediolico. In presenza di ossigeno e metalli l'acido ascorbico tende a ossidarsi e a formare acido deidroascorbico e acqua ossigenata.
Grazie alla forte azione riducente la vitamina C è utilizzata in molte reazioni di ossidoriduzione. In particolare la vitamina è in grado di donare un elettrone, formando così l'acido semideidroascorbico che può donare un secondo elettrone, generando così l'acido deidroascorbico. I potenziali redox di queste reazioni sono:
- acido semiidroascorbico/acido ascorbico 0,28 V,
- acido deidroascorbico/acido semiidroascorbico −0,17 V.
Ciò fa della vitamina C un valido donatore di elettroni. L'acido deidroascorbico, il prodotto finale delle reazioni descritte, può venir ridotto da parte della deidroascorbato reduttasi, un enzima dipendente dal glutatione, rigenerando così l'acido ascorbico. Solamente l'enantiomero L è biologicamente attivo.
Per la spiccata azione antiossidante della vitamina C e la sua capacità di mantenere stabili le vitamine A, E, l'acido folico e la tiamina, la vitamina C viene utilizzata dall'industria alimentare come additivo nei cibi, come tale o sotto forma di sale sodico, potassico e calcico.
L'acido ascorbico è anche usato come rivelatore per la fotografia analogica in bianco e nero grazie alle sue proprietà riducenti.
Sigle internazionali
Le sigle con cui l'Unione europea indica la vitamina C e i suoi sali, che sono additivi alimentari importanti per la conservazione dei prodotti nell'industria, sono:
- E300 per l'acido ascorbico;
- E301 per l'ascorbato di sodio;
- E302 per l'ascorbato di calcio;
- E303 per l'ascorbato di potassio;
- E304 indica un estere formato dall'unione dell'acido ascorbico con un acido grasso (palmitato o stearato).
L'ascorbato di potassio è stato rimosso dalla lista degli additivi approvati dall'Unione europea.
Effetti sull'organismo
La vitamina C è importante per il corretto funzionamento del sistema immunitario e per la sintesi di collagene nell'organismo. Il collagene rinforza i vasi sanguigni, la pelle, i muscoli e le ossa. L'uomo non può creare collagene senza la vitamina C.
Sembra che la vitamina C abbia un ruolo importante soprattutto in reazioni di ossidoriduzione catalizzate da ossigenasi e che svolga un'azione antistaminica. Tra i processi più noti in cui la vitamina dovrebbe intervenire ci sono:
- idrossilazione della lisina e della prolina da parte della prolina idrossilasi e della lisina idrossilasi, reazioni importanti per la maturazione del collagene;
- idrossilazione della dopamina per formare la noradrenalina;
- sintesi della carnitina;
- catabolismo della tirosina;
- amidazione di alcuni peptidi con azione ormonale;
- sintesi degli acidi biliari;
- sintesi degli ormoni steroidei per intervento durante le reazioni di idrossilazione;
- riduzione dell'acido folico per costruire la forma coenzimatica;
- aumento dell'assorbimento di ferro per riduzione del Fe (III) a Fe (II);
- azione di rigenerazione della vitamina E per cessione di un elettrone al radicale α-tocoferossilico.
Inoltre sembra che la vitamina C possa diminuire la formazione di nitrosammine intestinali e ridurre vari composti ossidanti tra cui il radicale superossido, l'acido ipocloroso e i radicali idrossilici.
Recenti studi sull'acido ascorbico indicano che può ridurre il tempo di ventilazione nei pazienti in condizioni critiche.
Analisi quantitative e fonti alimentari
|
Alimento |
(mg/100g) Vit. C |
|---|---|
| Terminalia ferdinandiana | 3100 |
| Acerola | 1300-1700 |
| Rosa canina | 1250 |
| Peperoncini piccanti | 229 |
| Peperoncini rossi e gialli | 166 |
| Peperoni crudi | 151 |
| Peperoni verdi | 127 |
| Rughetta o rucola | 110 |
| Broccoli | 110 |
| Kiwi | 85 |
| Cavoletti di Bruxelles | 81 |
| Bacche di Goji | 80 |
| Lattuga | 59 |
| Fragole/Clementine | 54 |
| Limoni/Arance | 50 |
| Succo di arance | 44 |
| Succo di limoni | 43 |
| Mandarini | 42 |
| Pompelmo | 40 |
| Fave fresche crude | 33 |
| Piselli freschi crudi | 32 |
| Piselli surgelati | 30 |
| Pomodori maturi | 25 |
| Pomodori San Marzano | 24 |
| Kaki | 23 |
| Aronia | 21 |
| Pomodori da insalata | 21 |
| Ananas | 17 |
| Fegato/Rene | 10-40 |
| Finocchi crudi | 12 |
| Cocomero | 8 |
È possibile determinare la quantità di vitamina C in diverse sostanze attraverso l'utilizzo del reattivo di Lugol; la reazione che avviene tra l'acido ascorbico e il reattivo di Lugol è:
Lo iodio ossida con facilità l'acido ascorbico convertendolo in acido deidroascorbico. Nelle analisi quantitative il campione di acido ascorbico viene trattato con una quantità nota di iodio superiore a quella necessaria a ossidare l'intero campione; l'eccesso di iodio non reagito viene quindi retrotitolato con una soluzione a concentrazione nota di tiosolfato di sodio.
La vitamina C è presente in alcuni alimenti, insieme con bioflavonoidi, soprattutto nei vegetali a foglia verde, peperoni, pomodori, kiwi e negli agrumi, particolarmente concentrata nel frutto di ciliegia amazzonica, l'acerola, e nella rosa canina. La vitamina può perdersi nel caso in cui questi alimenti vengano tenuti all'aria per molto tempo o dentro contenitori di metallo, per esempio di rame.
La cottura può comportare perdita di vitamina (in taluni casi fino al 75%); questa perdita può essere ridotta adottando una cottura che sia il più possibile rapida
Livelli di assunzione e tossicità
Carenza
La carenza di vitamina C determina la comparsa dello scorbuto, patologia che riguarda particolarmente l'insufficiente produzione di collagene e di sostanza cementante intercellulare. Ciò determina alterazioni a livello dei vasi sanguigni con comparsa di emorragie, rallentamento della cicatrizzazione delle ferite, gengiviti con alterazioni della dentina, gengivorragie e osteoporosi. Nei bambini si ha anche un arresto della crescita. Le varie emorragie sviluppantesi possono portare anche a un quadro di anemia sideropenica.
Bassi livelli di acido ascorbico sufficienti alla sopravvivenza, ma al di sotto di quelli necessari, sembrano favorire l'aterosclerosi, sia per l'ipotesi ossidativa sia per l'ipotesi risposta alla lesione. Per la scarsità di vitamina C nell'organismo si instaurano situazioni come la progressiva crescita dell'azione devastante dello stress ossidativo e dei radicali liberi sulle pareti cellulari vascolari e/o il progressivo impoverimento e cedimento di collagene nelle pareti cellulari vascolari che venendo tamponato da derivati di alfa lipoproteine produce, col progressivo accumulo, l'aterosclerosi e, di conseguenza, tutte le altre pericolosissime sue patologie derivate a cascata.
Avvertenze riguardanti l'utilizzo e la somministrazione come farmaco
Poiché la vitamina C diminuisce i livelli di acido urico, il consumo di elevate quantità di vitamina potrebbe avere un effetto preventivo verso l'iperuricemia (concentrazione sierica di acido urico > 6 mg/dL) e la gotta.
La vitamina C può provocare emolisi nei pazienti con carenza eritrocitaria di G6PD o favismo.
La somministrazione di vitamina C per via orale come forma farmaceutica solida (compresse) è stata associata a danni esofagei dovuti all'acidificazione del pH o della soluzione acquosa in cui è disciolta la compressa o della saliva. Il danno esofageo in genere è risultato transitorio e autolimitante ed è consistito nella formazione di ulcere localizzate che regrediscono dopo la sospensione del farmaco e non causano stenosi.
Dose minima giornaliera
Per dose minima giornaliera s'intende la quantità minima complessiva da assumere durante il corso dell'intera giornata, suddividendo la dose giornaliera in parti uguali assunte a intervalli di 3-4 ore.
Si calcola che la quantità minima di vitamina C necessaria per prevenire lo scorbuto sia di circa 10 mg/die, tuttavia le quantità raccomandate dai sistemi sanitari sono di poco superiori. Anzi, nella comunità scientifica vi è ancora acceso dibattito sul dosaggio efficace effettivo, su limite soglia e sovradosaggio.
Le indicazioni degli organismi governativi sono:
- 30 mg/die per il Codex Alimentarius
- 40 mg/die in Regno Unito (Food Standards Agency)
- 45 mg/die per l'OMS-WHO
- 60 mg/die in Canada
- 75–120 mg/die per gli adulti, 2 g/die come limite di tolleranza: Food and Nutrition Board, Institute of Medicine, National Academy of Sciences, Ministero della Salute, USA.
Nella medicina alternativa
Sebbene alcune medicine alternative, come per esempio la medicina ortomolecolare, propongano megadosi di vitamina C come pratica terapeutica, non esistono prove scientifiche in merito e in taluni casi sono anzi controindicate.
Uno degli effetti certi del sovradosaggio di vitamina C è la diarrea. Non esiste una dose letale accertata per l'uomo, esiste invece una LD50 per i ratti che corrisponde a 11,9 grammi per chilogrammo di peso corporeo in una sola dose per via orale. Un uomo medio di 70 kg dovrebbe dunque ingerirne circa 850 g in un'unica soluzione.
Dosi superiori ai 1 g/die di vitamina C, assunte sotto forma di acido ascorbico, possono portare alla presenza di disturbi (nausea, mal di testa, ecc.). Inoltre secondo alcuni studi sembra che venga aumentata l'eliminazione tramite le urine di ossalati, che potrebbero facilitare la formazione di calcoli renali in un numero limitato di soggetti.
Nuove frontiere
La sintesi chimica dell'acido L-ascorbico è un procedimento complesso che prevede molti passaggi chimici che partono dal D-glucosio e un unico passaggio enzimatico che coinvolge la sorbitolo-deidrogenasi. L'ultimo stadio del processo prevede la trasformazione catalizzata da acidi dell'acido 2-cheto-L-gulonico (2-KLG) in acido L-ascorbico.
È stato osservato che in natura alcuni batteri (Acetobacter, Gluconbacter ed Erwinia) sono in grado di trasformare il glucosio in acido 2,5-dicheto-D-gulonic (2,5-DKG), mentre altri (Corynebacterium, Brevibacterium e Arthrobacter) sono in grado di trasformare l'acido 2,5-DKG in acido 2-KLG grazie all'enzima 2,5-DKG-riduttasi. Grazie alla tecnologia del DNA ricombinante è stato possibile isolare il gene della 2,5-DKG-riduttasi dalla specie Corynebacterium ed esprimerlo in Erwinia berbicola, in grado di trasformare il glucosio in 2,5-DKG grazie a tre enzimi. Le cellule di Erwinia così trasformate sono in grado di trasformare direttamente il glucosio in acido 2-KLG.
Bibliografia
- (EN) J.C. Beaglehole (a cura di), The Journals of Captain James Cook on His Voyages of Discovery, vol. I: The Voyage of the Endeavour 1768–1771, Cambridge University Press, 1968, OCLC 223185477.
- (EN) An historical compendium of 20th-Century medical & scientific literature attesting to the efficacy of Ascorbate (Vitamin C) in the treatment and prevention of human and animal illnesses and diseases, su seanet.com.
- Aldo Mariani Costantini, Carlo Cannella e Giovanni Tomassi, Fondamenti di Nutrizione Umana, su pensiero.it, Il Pensiero Scientifico Editore, 2006.
- (EN) L.K. Massey, M. Liebman e S.A. Kynast-Gales, Ascorbate increases human oxaluria and kidney stone risk, in Journal of Nutrition, 135(7), luglio 2005, pp. 1673-7.
- Linus Pauling, Come vivere più a lungo e sentirsi meglio (PDF) , su static.scribd.com, Edizioni Frassinelli, 1989.
- (EN) W. Chai, M. Liebman, S. Kynast-Gales e L. Massey, Oxalate absorption and endogenous oxalate synthesis from ascorbate in calcium oxalate stone formers and non-stone formers, in American Journal of Kidney Diseases, 44(6), dicembre 2004, pp. 1060-9.
- (EN) B.L. Auer, D. Auer e A.L., Relative hyperoxaluria, crystalluria and haematuria after megadose ingestion of vitamin C, in Journal of Clinical Investigation, 28(9), settembre 1998, pp. 695-700.
- (EN) B.L. Auer, D. Auer e A.L. Rodgers, The effect of ascorbic acid ingestion on the biochemical and physicochemical risk factors associated with calcium oxalate kidney stone formation, 36(3), marzo 1998, pp. 143-7.
- (EN) H.C. Gorton e K Jarvis, The effectiveness of vitamin C in preventing and relieving the symptoms of virus-induced respiratory infections, in Journal of Manipulative and Physiological Therapeutics, 22(8), ottobre 1999, pp. 530-3.
- (EN) E. Cameron e L. Pauling, Supplemental ascorbate in the supportive treatment of cancer: Prolongation of survival times in terminal human cancer.
- (EN) E. Cameron e L. Pauling, Supplemental ascorbate in the supportive treatment of cancer: reevaluation of prolongation of survival times in terminal human cancer.
- (EN) F.T. Creagan, C.G. Moertel, J.R. O'FalIon e et al., Failure of high-dose vitamin C (ascorbic acid) to benefit patients with advanced cancer: a controlled trial, n. 301, 1979, pp. 687-690.
- (EN) Balz Frei e Stephen Lawson, Vitamin C and cancer revisited.
- (EN) K.T. Khaw, S. Bingham, A. Welch, R. Luben, N. Wareham, S. Oakes e N. Day, Relation between plasma ascorbic acid and mortality in men and women in EPIC-Norfolk prospective study: a prospective population study, in European Prospective Investigation into Cancer and Nutrition. Lancet, 357(9257), 3 marzo 2001, pp. 657-63.
- (EN) Qi Chen, Michael Graham Espey, Andrew Y. Sun, Je-Hyuk Lee, Murali C. Krishna, Emily Shacter, Peter L. Choyke, Chaya Pooput, Kenneth L. Kirk, Garry R. Buettner e Mark Levine, Pharmacologic ascorbic acid concentrations selectively kill cancer cells: Action as a pro-drug to deliver hydrogen peroxide to tissues.
- (EN) Qi Chen, Michael Graham Espey, Andrew Y. Sun, Je-Hyuk Lee, Murali C. Krishna, Emily Shacter, Peter L. Choyke, Chaya Pooput, Kenneth L. Kirk, Garry R. Buettner e Mark Levine, Ascorbate in pharmacologic concentrations selectively generates ascorbate radical and hydrogen peroxide in extracellular fluid in vivo.
Altri progetti
Altri progetti
-
 Wikiquote contiene citazioni sull'acido ascorbico
Wikiquote contiene citazioni sull'acido ascorbico
-
 Wikimedia Commons contiene immagini o altri file sull'acido ascorbico
Wikimedia Commons contiene immagini o altri file sull'acido ascorbico
Collegamenti esterni
- ascorbico, acido, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) Acido ascorbico, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Vitamina C o Acido ascorbico: alimenti, fabbisogno giornaliero e sintomi da carenza, su glossario.tuttovitamine.it. URL consultato il 15 settembre 2010 (archiviato dall'url originale il 30 agosto 2010).
- SINU-Società Italiana di Nutrizione Umana, su sinu.it. URL consultato il 6 gennaio 2005 (archiviato dall'url originale il 12 gennaio 2012).
- Articolo dell'INRAN-Istituto Nazionale di Ricerca per gli Alimenti e la Nutrizione, su inran.it. URL consultato il 7 novembre 2018 (archiviato dall'url originale il 7 novembre 2018). ( inran.it.)
- (EN) Lista degli additivi alimentari approvati dalla Unione Europea, su elc-eu.org. URL consultato il 10 agosto 2009 (archiviato dall'url originale il 14 luglio 2009).
- Acido ascorbico, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana.
| Controllo di autorità | GND (DE) 4063638-0 |
|---|
