
Sistema immunitario

Il sistema immunitario è una complessa rete integrata di mediatori chimici e cellulari, di strutture e processi biologici, sviluppatasi nel corso dell'evoluzione, per difendere l'organismo da qualsiasi forma di insulto chimico, traumatico o infettivo alla sua integrità. Per funzionare correttamente, un sistema immunitario deve essere in grado di rilevare un'ampia varietà di agenti, noti come agenti patogeni, dai virus agli elminti e distinguerli dal proprio tessuto sano dell'organismo.
In molte specie, il sistema immunitario può essere classificato in sottosistemi, come il sistema immunitario innato opposto al sistema immunitario adattativo o l'immunità umorale opposta all'immunità cellulo-mediata. Negli esseri umani, la barriera emato-encefalica, la barriera sangue-fluido cerebrospinale, e altre simili barriere fluido-cerebrale, separano il sistema immunitario periferico dal sistema neuroimmune che protegge il cervello.
Gli agenti patogeni possono rapidamente evolversi e adattarsi, riuscendo quindi a evitare di essere scoperti e neutralizzati da parte del sistema immunitario; tuttavia, si sono evoluti diversi meccanismi di difesa per ovviare a ciò. Anche semplici organismi unicellulari, come i batteri, possiedono un sistema immunitario rudimentale, costituito da enzimi che proteggono contro le infezioni dei batteriofagi. Altri meccanismi immunitari di base si sono evoluti negli antichi eucarioti e rimangono nei loro discendenti moderni, come le piante e gli invertebrati. Questi comprendono la fagocitosi, peptidi antimicrobici chiamati defensine e il sistema del complemento.
Gli gnatostomi, inclusi gli esseri umani, vantano meccanismi difensivi ancora più sofisticati, tra cui la capacità di adattarsi nel tempo a riconoscere gli agenti patogeni specifici in modo più efficiente. L'immunità adattativa crea una memoria immunologica a seguito di una prima risposta ad un agente patogeno specifico, portando così a una migliore reazione agli eventuali incontri successivi con lo stesso agente patogeno. Questo processo di immunità acquisita è alla base della vaccinazione.
I disturbi del sistema immunitario possono causare malattie autoimmuni, malattie infiammatorie e tumori. L'immunodeficienza si verifica quando il sistema immunitario risulta meno attivo del normale, con conseguenti infezioni ricorrenti e pericolose per la vita. Negli esseri umani, l'immunodeficienza può essere il risultato di una malattia genetica come l'immunodeficienza combinata grave, o acquisita per via di malattie come l'HIV/AIDS, o per l'uso di farmaci immunosoppressori. Al contrario, l'autoimmunità da un sistema immunitario iperattivo comporta l'attacco ai tessuti normali, come se fossero organismi estranei. Le malattie autoimmuni più comuni sono la tiroidite di Hashimoto, l'artrite reumatoide, il diabete mellito di tipo 1 e il lupus eritematoso sistemico. L'immunologia riguarda lo studio di tutti gli aspetti del sistema immunitario.
Indice
- 1 Storia dell'immunologia
- 2 Descrizione generale
- 3 Sistema immunitario innato
- 4 Sistema immunitario adattativo
- 5 Disturbi dell'immunità umana
- 6 Altri meccanismi e l'evoluzione
- 7 Immunologia dei tumori
- 8 Regolazione fisiologica
- 9 Manipolazione in medicina
- 10 Note
- 11 Bibliografia
- 12 Voci correlate
- 13 Altri progetti
- 14 Collegamenti esterni
Storia dell'immunologia
L'immunologia è la disciplina che studia la struttura e la funzione del sistema immunitario. Ha origine dalla medicina e dai primi studi sulle cause dell'immunità alle malattie. Il riferimento più antico conosciuto all'immunità risale alla peste di Atene nel 430 a.C. Tucidide aveva osservato che coloro che erano guariti erano in grado di assistere i malati senza contrarre la malattia per la seconda volta. Nel XVIII secolo, Pierre Louis Moreau de Maupertuis fece degli esperimenti con il veleno dello scorpione, osservando che alcuni cani e topi erano immuni ad esso. Questa ed altre osservazioni riguardo all'immunità acquisita, sono state successivamente sfruttate da Louis Pasteur nel suo sviluppo della vaccinazione e della sua proposta della teoria dei germi della malattia. La teoria di Pasteur era in diretta opposizione alle teorie coeve della malattia, come la dottrina miasmatico-umorale. È stato necessario aspettare fino al 1891 con i lavori di Robert Koch, per i quali gli venne assegnato il premio Nobel nel 1905, affinché i microrganismi potessero essere confermati come causa delle malattie infettive. I virus sono stati individuati come agenti patogeni umani nel 1901, con la scoperta del virus della febbre gialla da parte di Walter Reed.
Verso la fine del XIX secolo, l'immunologia ha fatto un grande progresso grazie a rapidi sviluppi nello studio sull'immunità umorale e l'immunità cellulare. Particolarmente importante è stata l'opera di Paul Ehrlich, che ha proposto la teoria catena laterale per spiegare la specificità della reazione antigene-anticorpo; il suo contributo alla comprensione della immunità umorale gli è stata riconosciuta con l'attribuzione di un premio Nobel nel 1908, assegnato congiuntamente al fondatore dell'immunologia cellulare, Il'ja Il'ič Mečnikov.
Descrizione generale
Una caratteristica fondamentale del sistema immunitario è quindi la capacità di distinguere tra le strutture endogene o esogene che non costituiscono un pericolo e che dunque possono o devono essere preservate (self) e le strutture endogene o esogene che invece si dimostrano nocive per l'organismo e che devono quindi essere eliminate (non-self).
Secondo le più recenti teorie il sistema immunitario distingue dunque un non-infectious self (self non infettivo) da un infectious self (self infettivo). La discriminazione tra self e non self avviene a livello molecolare ed è mediata da particolari strutture cellulari (Toll-like receptor, recettori dei linfociti T, complessi MHC, anticorpi), che consentono la presentazione ed il riconoscimento di componenti dell'agente lesivo definite antigeni (letteralmente induttori di anticorpi).
A seconda delle modalità di riconoscimento degli antigeni si possono distinguere due aree del sistema immunitario:
- immunità aspecifica o innata: comprende mediatori chimici (responsabili dell'infiammazione) e cellulari responsabili di una prima linea di difesa contro le aggressioni. È evolutivamente più antica e consente il riconoscimento di un repertorio limitato di antigeni. Riconosce una generica condizione di pericolo e pone il sistema immunitario in una condizione di “allarme”, che favorisce lo sviluppo dell'immunità specifica
- immunità specifica o acquisita o adattativa: comprende mediatori chimici e cellulari responsabili di una risposta difensiva più potente e mirata (virtualmente in grado di riconoscere qualunque forma di antigene), ma più lenta. È evolutivamente più recente e poggia sulla risposta aspecifica per numerose funzioni di presentazione e distruzione degli antigeni. Si divide a sua volta in:
- immunità specifica umorale (cioè mediata da anticorpi).
- immunità specifica cellulo-mediata
Difesa a più livelli
Il sistema immunitario protegge gli organismi dalle infezioni grazie a una difesa di più livelli di crescente specificità. In termini semplici, le barriere fisiche impediscono agli agenti patogeni, come batteri e virus, di entrare nell'organismo. Se un patogeno supera queste barriere, il sistema immunitario innato fornisce una risposta immediata, ma non specifica. Il sistema immunitario innato si trova in tutte le piante e gli animali. Se patogeni eludono con successo anche la risposta innata, i vertebrati possiedono un secondo livello di protezione, il sistema immunitario adattativo, che viene attivato dalla risposta innata. Qui, il sistema immunitario adatta la sua risposta durante l'infezione migliorando il riconoscimento del patogeno. Questa migliore risposta viene poi mantenuta dopo che il patogeno è stato eliminato, in forma di una memoria immunologica, permettendo così al sistema immunitario adattativo di rispondere più velocemente e più efficacemente ogni volta che incontrerà nuovamente questo patogeno.
| Sistema immunitario innato | Sistema immunitario adattativo |
|---|---|
| La risposta è non specifica | Risposta specifica ai patogeni e antigeni |
| L'esposizione porta all'immediata risposta massima | Intervallo di tempo tra l'esposizione e la risposta massima |
| Immunità umorale e cellulo mediata | Immunità umorale e cellulo mediata |
| Nessuna memoria immunologica | L'esposizione porta alla memoria immunologica |
| Trovato in quasi tutte le forme di vita | Trovato solo negli gnatostomi |
Sia l'immunità innata che quella adattativa, dipendono dalla capacità del sistema immunitario di distinguere tra molecole self e non-self. Nell'immunologia, le molecole self sono quelle che compongono l'organismo e che possono essere distinte dalle sostanze estranee dal sistema immunitario. Al contrario, le molecole non-self, sono quelle riconosciute come molecole estranee. Una classe di molecole non-self sono chiamate "antigeni" (abbreviazione di generatori di anticorpi) e sono definite come sostanze che si legano a specifici recettori immunitari suscitando una risposta immunitaria.
Sistema immunitario innato
I microrganismi o le tossine che entrano con successo nell'organismo, incontrano le cellule e dei processi del sistema immunitario innato. Solitamente, la risposta innata si attiva quando i microbi vengono identificati dai Pattern Recognition Receptors (PRR), in grado di riconoscere i componenti dei grandi gruppi di microrganismi, le eventuali cellule danneggiate o stressati, inviando segnali di allarme. Le difese immunitarie innate sono dunque "non-specifiche", il che significa questi sistemi rispondono agli agenti patogeni in modo generico. Questo sistema non conferisce immunità duratura contro un patogeno. Nella maggior parte degli organismi viventi, il sistema immunitario innato è il sistema dominante della difesa.
Barriere di superficie
Diverse barriere, sia meccaniche, chimiche o biologiche, proteggono gli organismi dalle infezioni. La cuticola cerosa di molte foglie, l'esoscheletro degli insetti, le conchiglie, le membrane esterne delle uova depositate e la cute sono esempi di barriere meccaniche che funzionano come prima linea di difesa contro le infezioni. Tuttavia gli organismi non possono essere completamente isolati dai loro ambienti, pertanto altri sistemi agiscono per proteggere le varie aperture presenti nel corpo, come i polmoni, l'intestino e l'apparato uro-genitale. Nei polmoni, la tosse e gli starnuti sono sistemi meccanici in grado di espellere patogeni e altre sostanze irritanti dalle vie respiratorie. Le lacrime hanno un'azione di lavaggio e con l'urina vengono espulsi anche agenti patogeni, mentre il muco secreto dal tratto respiratorio e gastrointestinale serve ad intrappolare i microrganismi.
Vi sono anche barriere chimiche che proteggono contro l'infezione. La pelle e le vie respiratorie secernono peptidi antimicrobici come le defensine β. Gli enzimi come il lisozima e la fosfolipasi A2 presenti nella saliva, nelle lacrime e nel latte materno, sono anche degli antibatterici. Le secrezioni vaginali acquistano una funzione di barriera chimica, dopo il menarca, quando diventano leggermente acide, mentre il liquido seminale contiene defensine e zinco per uccidere gli agenti patogeni. Nello stomaco, l'acido gastrico e la proteasi sono potenti difese chimiche contro gli agenti patogeni ingeriti.
Nei tratti genitourinari e gastrointestinali, la flora commensale serve come barriera biologica, competendo con i batteri patogeni per il cibo e lo spazio e, in alcuni casi, modificando le condizioni del loro ambiente, come il pH o la disponibilità di ferro, riducendo la probabilità che gli agenti patogeni possano raggiungere una quantità sufficiente per causare una malattia. Tuttavia, poiché gli antibiotici sono volti a eliminare i batteri e non influenzano invece i funghi, se somministrati per via orale possono portare a un'"eccessiva" presenza di funghi e causare patologie come la candidosi vaginale. Vi sono buone evidenze che la reintroduzione della flora probiotica, come le colture pure di lactobacillus normalmente presenti nello yogurt non pastorizzato, aiuta a ripristinare un sano equilibrio delle popolazioni microbiche durante le infezioni intestinali nei bambini, mentre dati preliminari ottenuti in diversi studi, incoraggiano tale pratica nei casi di gastroenterite batterica, malattie infiammatorie croniche intestinali, infezioni delle vie urinarie e le infezioni post-chirurgiche.
Infiammazione
L'infiammazione è una delle prime risposte del sistema immunitario alle infezioni. I sintomi dell'infiammazione sono arrossamento, gonfiore, calore e dolore, tutti causati da un aumento del flusso sanguigno nel tessuto. L'infiammazione è prodotta da eicosanoidi e citochine, che vengono rilasciate dalle cellule danneggiate o infettate. Gli eicosanoidi comprendono le prostaglandine che inducono la febbre e la dilatazione dei vasi sanguigni associati con l'infiammazione, e i leucotrieni che attirano alcuni globuli bianchi (leucociti). Le citochine comuni includono le interleuchine, responsabili della comunicazione tra le cellule bianche del sangue, le chemochine che promuovono la chemiotassi e gli interferoni che presentano effetti anti-virali, come l'arresto della sintesi proteica nella cellula colpita. Durante l'evento infiammatorio, possono anche essere rilasciati i fattori di crescita e i fattori citotossici. Queste citochine e altre sostanze chimiche possono reclutare altre cellule immunitarie al sito di infezione e, dopo che gli agenti patogeni sono stati rimossi, promuovere la guarigione di qualsiasi tessuto danneggiato.
Il sistema del complemento
Il sistema del complemento è una cascata biochimica che attacca le superfici delle cellule estranee. Esso contiene oltre 20 diverse proteine ed è così chiamato per la sua capacità di "completare" l'uccisione degli agenti patogeni da parte degli anticorpi. Il complemento è il principale componente umorale della risposta immunitaria innata. Molte specie hanno sistemi del complemento, compresi i non-mammiferi come le piante, i pesci e alcuni invertebrati.
Negli esseri umani, questa risposta è attivata dal legame con gli anticorpi che sono correlati a questi microbi o il legame di proteine del complemento ai carboidrati presenti sulle superfici dei microbi. Questo segnale di riconoscimento innesca una risposta che comporta una rapida uccisione. La velocità della risposta è il risultato dell'amplificazione del segnale che si verifica dopo l'attivazione proteolitica sequenziale delle molecole di complemento, che sono anche proteasi. Dopo che le proteine del complemento inizialmente si legano al microbo, innescano l'attività della proteasi, che a sua volta attiva altre proteasi del complemento, e così via. Questo produce una cascata catalitica che amplifica il segnale iniziale, tramite un feedback positivo. I risultati della cascata consistono nella produzione di peptidi che attraggono le cellule immunitarie, aumentano la permeabilità vascolare e rivestono con le opsonine la superficie di un patogeno, marcandolo per la distruzione. Questa deposizione di complemento può anche uccidere le cellule direttamente, interrompendo la loro membrana plasmatica.
Barriere cellulari

I leucociti (globuli bianchi), si comportano come organismi unicellulari indipendenti e sono il secondo livello del sistema immunitario innato. I leucociti innati comprendono i fagociti (macrofagi, neutrofili e cellule dendritiche), i linfociti, mastociti, eosinofili, basofili e i linfociti natural killer. Queste cellule identificano ed eliminano gli agenti patogeni, sia attaccando quelli più grandi attraverso il contatto o inglobando e poi uccidendo i microrganismi più piccoli. Le cellule innate sono anche mediatori importanti nello sviluppo degli organi linfoidi e per l'attivazione del sistema immunitario adattativo.
La fagocitosi è una caratteristica importante delle cellule dell'immunità innata e viene effettuata da cellule chiamate "fagociti" in grado quindi di fagocitare, o mangiare, gli agenti patogeni o le particelle. I fagociti generalmente pattugliano il corpo alla ricerca di agenti patogeni, ma possono essere chiamati in luoghi specifici dalle citochine. Una volta che un agente patogeno viene travolto da un fagocita, viene intrappolato in una vescicola intracellulare chiamato fagosoma, che si fonde poi con un'altra vescicola, chiamata lisosoma, per formare un fagolisosoma. L'agente patogeno viene ucciso dall'attività degli enzimi digestivi o a seguito di uno scoppio respiratorio che rilascia radicali liberi nel fagolisosoma. La fagocitosi si è evoluta come un mezzo per acquisire sostanze nutritive, ma questo ruolo è stato ampliato nei fagociti per includere l'inghiottimento degli agenti patogeni come meccanismo di difesa. La fagocitosi rappresenta probabilmente la forma più antica di difesa; i fagociti sono stati identificati sia negli animali vertebrati che negli invertebrati.

I neutrofili e i macrofagi sono fagociti che viaggiano in tutto il corpo alla ricerca di agenti patogeni. I neutrofili sono normalmente presenti nel sangue e sono il tipo più abbondante di fagociti, normalmente pari al 50% - 60% del totale dei leucociti circolanti. Durante la fase acuta dell'infiammazione, in particolare a seguito di un'infezione batterica, i neutrofili migrano verso il sito di infiammazione in un processo chiamato chemiotassi e solitamente sono le prime cellule ad arrivare sulla scena dell'infezione. I macrofagi sono cellule versatili che risiedono all'interno dei tessuti e producono una vasta gamma di sostanze chimiche tra cui enzimi, proteine del complemento e citochine, mentre possono anche agire come "spazzini" per liberare l'organismo da cellule logore e altri detriti e come le cellule presentanti l'antigene, attivano il sistema immunitario adattativo. I macrofagi svolgono funzioni di fagocitosi e digestione ossidativa degli agenti patogeni, ma intervengono in genere nelle fasi tardive dell'infiammazione acuta o nell'infiammazione cronica. Hanno legami molto stretti con le cellule dell'immunità specifica in quanto dipendono da queste ultime per raggiungere una completa attivazione e ne influenzano il differenziamento nelle fasi precoci della risposta immunitaria specifica; inoltre possono contribuire alla presentazione antigenica.

I mastociti risiedono nei tessuti connettivi e le membrane mucose e regolano la risposta infiammatoria. Essi sono più spesso associati con l'allergia e l'anafilassi. I basofili e gli eosinofili sono legati ai neutrofili. Essi secernono mediatori chimici che sono coinvolti nella difesa contro i parassiti e svolgono un ruolo nelle reazioni allergiche, come nel caso dell'asma. I linfocita NK (natural killer), sono leucociti che attaccano e distruggono le cellule tumorali o le cellule che sono state infettate da virus.
Le cellule dendritiche sono fagociti che si trovano nei tessuti, sono morfologicamente e funzionalmente specializzate nella cattura e nella presentazione di antigene, e hanno la caratteristica di essere contatto con l'ambiente esterno; di conseguenza, si trovano principalmente nella cute, nel naso, nei polmoni, nello stomaco e nell'intestino. Esse sono così chiamate per la loro somiglianza con i dendriti neuronali, ma le cellule dendritiche non sono in alcun modo correlate al sistema nervoso. Le cellule dendritiche fungono da collegamento tra i tessuti corporei e il sistema immunitario innato e adattativo, in quanto sono in grado di presentare antigeni alle cellule T, uno dei principali tipi di cellule del sistema immunitario adattativo.
Linfociti natural killer
I linfociti natural killer, o cellule NK, sono un componente del sistema immunitario innato, che non attacca direttamente i microbi invasori. La loro specializzazione, infatti, è distruggere le cellule dell'organismo compromesse, come le cellule tumorali o le cellule infettate da virus, riconoscendole grazie ad una condizione nota come "missing self". Questo termine descrive cellule con bassi livelli di un marker presente sulla superficie cellulare chiamato MHC I (complesso maggiore di istocompatibilità), una situazione che può verificarsi nelle infezioni virali. Esse sono state nominate "natural killer" a causa della nozione iniziale, che non richiedono l'attivazione, al fine di uccidere le cellule. Per molti anni non era chiaro come le cellule NK riconoscessero le cellule tumorali e le cellule infette. È ormai noto che il marker MHC sulla superficie di queste cellule risulta alterato e le cellule NK si attivano attraverso il riconoscimento del "missing self". Le cellule del corpo normali non sono riconosciute e attaccate dalle cellule NK, poiché esse esprimono auto antigeni MHC intatti.
Sistema immunitario adattativo

Il sistema immunitario adattativo (noto anche come "immunità specifica" o "immunità acquisita") si è evoluto nei primi vertebrati e consente una risposta immunitaria più forte, così come la memoria immunologica, in cui ogni agente patogeno viene "ricordato". La risposta immunitaria adattativa è antigene-specifica e richiede il riconoscimento di specifici antigeni "non-self" nel corso di un processo chiamato di presentazione dell'antigene. La specificità antigenica consente la generazione di risposte che sono su misura per specifici agenti patogeni o per le cellule dell'organismo infettate dal patogeno. La possibilità di intraprendere queste risposte adeguate viene mantenuta nel corpo grazie a "cellule di memoria". Se un agente patogeno infetta l'organismo più di una volta, queste cellule di memoria specifiche vengono utilizzate per eliminarlo rapidamente.
Il sistema immunitario adattativo è costituito prevalentemente da cellule della linea linfoide (della serie T e B) e da cellule accessorie. I linfociti T si suddividono in linfociti T helper CD4+ e linfociti T citotossici (CTL) CD8+. La funzione effettrice dei primi è quella di coordinare il complesso della risposta immunitaria attivando linfociti CD8+ e macrofagi (T-helper 1) o linfociti B (T-helper 2) e di sostenere il processo infiammatorio. Tale attività è svolta attraverso interazioni cellula-cellula o mediante rilascio di particolari fattori solubili detti citochine.
La funzione effettrice dei linfociti CD8+ è quella di lisare le cellule infette grazie alla produzione delle linfochine. I linfociti B attivati si specializzano invece in cellule secernenti anticorpi (plasmacellulle). Le cellule accessorie sono le cellule reclutate dal compartimento innato del sistema immunitario. A differenza dell'immunità aspecifica o innata, l'immunità specifica o acquisita è stata selezionata dall'evoluzione per la sua capacità di adattarsi dinamicamente alla variabilità di agenti ambientali riconosciuti come un pericolo per l'organismo. Tale variabilità è ovviamente una caratteristica peculiare di molti microrganismi infettivi in continua co-evoluzione con il sistema immunitario che cerca di distruggerli.
L'immunità specifica deve dunque essere in grado di rispondere a tutte le possibili combinazioni molecolari presenti in natura e in grado di interagire con l'organismo. Poiché si stima che il numero di queste combinazioni si aggiri intorno a 1010, l'immunità adattativa deve dotarsi di un numero altrettanto vasto di strutture cellulari capaci di legare specificatamente ad ogni singolo antigene. Dato che però il genoma umano comprende complessivamente solo 30.000 geni è impossibile che ciascuna struttura di presentazione e riconoscimento antigenico sia codificata da un singolo gene. Questo paradosso può essere sciolto analizzando la composizione molecolare degli anticorpi, dei recettori dei linfociti T (TCR) e dei complessi MHC: si tratta infatti in tutti i casi di complessi proteici costituiti dalla combinazione di più strutture modulari codificate da molteplici (ma comunque numericamente limitate) varianti di geni dello stesso tipo. Ogni cellula del sistema immunitario adattativo nel corso della sua maturazione opera un riarrangiamento casuale del repertorio genetico ereditato dal soggetto in linea germinale generando una combinazione unica di MHC, TCR o anticorpi.
Un ulteriore raffinato meccanismo di generazione della diversità del patrimonio anticorpale (inteso in senso lato come il complesso delle strutture deputate al riconoscimento dell'antigene) è dato dall'inserimento di piccole mutazioni puntiformi all'interno dei geni che codificano per i moduli delle strutture di riconoscimento antigenico. Quest'ultimo fenomeno è particolarmente accentuato nei linfociti B in fase di maturazione tardiva (ipermutazione somatica).
Il riarrangiamento somatico delle strutture anticorpali è ovviamente un processo estremamente dispendioso, poiché determina la produzione di numerose varianti non funzionali. In altri termini ciascun individuo sviluppa autonomamente dal momento della nascita un sistema immunitario basato sui determinanti genetici ereditati in linea germinale, ma dotato di caratteristiche uniche e irripetibili dovute alla casualità degli eventi di ricombinazione e alla pressione selettiva dell'ambiente esterno. L'adozione di una forma di riconoscimento antigenico non precostituita e in grado di evolversi con la storia biologica dell'individuo pone il sistema immunitario nella necessità di dotarsi di alcune funzioni particolarmente evolute normalmente proprie di sistemi superiori come il sistema nervoso centrale.
Linfociti

Le cellule del sistema immunitario adattativo sono speciali tipi di leucociti, chiamati linfociti. I linfocita B e i linfociti T sono i principali tipi e derivano dalle cellule staminali ematopoietiche del midollo osseo. I linfociti B sono coinvolte nella risposta immunitaria umorale, mentre i linfociti T sono coinvolti nella risposta immunitaria cellulo-mediata.
Sia i linfociti B che T possiedono molecole recettoriali che riconoscono obiettivi specifici. I linfociti T riconoscono un bersaglio "non-self", come un agente patogeno, solo dopo che gli antigeni (piccoli frammenti del patogeno) sono stati elaborati e presentati in combinazione con un recettore "self" chiamato complesso maggiore di istocompatibilità (MHC). Esistono due principali sottotipi di linfociti T: i T killer e i T helper. In aggiunta vi sono le cellule T regolatorie che hanno un ruolo nella modulazione della risposta immunitaria. I linfociti T killer riconoscono solo gli antigeni accoppiati alle molecole MHC di classe I, mentre le cellule T helper e i linfociti T regolatori riconoscono solo gli antigeni accoppiati a molecole MHC di classe II. Questi due meccanismi di presentazione dell'antigene riflettono i diversi ruoli dei due tipi di linfociti T. Un terzo, sottotipo minore sono le linfociti T γδ che riconoscono gli antigeni intatti che non siano vincolati ai recettori MHC.
Al contrario, il recettore antigene-specifico dei linfociti B è una molecola anticorpale presente sulla loro superficie in grado di riconoscere patogeni interi, senza che vi sia la necessità della processazione dell'antigene. Ogni stirpe di linfociti B esprime un anticorpo diverso, in modo che il set completo dei recettori per l'antigene dei linfociti B rappresentino tutti gli anticorpi che il corpo può produrre.
Linfociti T killer
I linfociti T Killer sono un sottogruppo di linfociti T in grado di uccidere le cellule infettate da virus (e altri agenti patogeni) o altrimenti che risultino danneggiate o disfunzionali. Come con i linfociti B, ciascun tipo di T riconosce un antigene diverso. I linfociti T killer vengono attivati quando il loro recettore (TCR) si lega a questo antigene specifico in un complesso con il recettore per l'MHC di classe I di un'altra cellula. Il riconoscimento del complesso MHC-antigene viene aiutato da un co-recettore posto sul linfocita T e chiamato CD8. Il linfocita T viaggia attraverso il corpo alla ricerca di cellule dove i recettori MHC I portano questo antigene. Quando il linfocita viene attivato dal contatto con tali cellule, rilascia citochine, come la perforina che ha come bersagli i pori della membrana plasmatica della cellula bersaglio, permettendo così agli ioni, all'acqua e alle tossine di entrare. L'ingresso di un'altra tossina, chiamata granulisina (una proteasi). induce la cellula bersaglio a ricorrere all'apoptosi (una sorta di "suicidio cellulare"). L'uccisione delle cellule infettate da parte dei linfociti T risulta particolarmente importante per prevenire la replicazione del virus. L'attivazione dei linfociti T è strettamente controllata e in genere richiede un forte segnale di attivazione MHC/antigene, o segnali di attivazione aggiuntivi forniti dai linfociti T "helper" (vedi in seguito).
Linfociti T helper

I linfociti T helper regolano sia la risposta immunitaria innata che quella adattativa, oltre a promuovere la risposta stessa ad un particolare agente patogeno. Queste cellule non hanno alcuna attività citotossica e non uccidono le cellule infette o gli agenti patogeni direttamente; agiscono invece controllando l'azione immunitaria dirigendo gli altri linfociti ad eseguire queste attività.
I T helper esprimono i recettori delle cellule T (T cell receptors - TCR) che riconoscono l'antigene legato alle molecole MHC di classe II. L'antigene viene riconosciuto anche dal corecettore CD4 presente sui linfociti helper, che recluta le molecole all'interno del linfocita responsabili per l'attivazione dei linfociti T. In generale si può dire che lo scopo dei linfociti T helper è quello di secernere citochine in seguito a stimolazione antigenica fungendo da "aiutanti" sia nella risposta immunitaria adattativa che innata, in aperta contrapposizione ai CD8 citotossici che svolgono un'azione diretta nell'uccisione delle cellule. A partire dai linfociti T helper si sviluppano diverse sottopopolazioni in risposta alle citochine prodotte durante le fasi precoci della risposta. I linfociti T differenziati poi producono citochine che li caratterizzano, favorendo la propria popolazione e inibendo le altre. Questo differenziamento fa parte della specializzazione dell'immunità adattativa dal momento che, sottotipi diversi possiedono funzioni effetrici ben diverse. I segnali delle citochine migliorano la funzione microbicida dei macrofagi e l'attività delle cellule T killer. Inoltre, l'attivazione dei linfociti T helper provoca una sovraregolazione di molecole espresse sulla superficie del linfocita T, come il CD40 ligando, che forniscono dei segnali stimolatori supplementari necessari per attivare i linfociti B produttori di anticorpi.
Linfociti T γδ
I linfociti T γδ costituiscono un'esigua minoranza dei linfociti T ed esprimono un recettore alternativo TCR di tipo γδ rispetto ai linfociti T (αβ) CD4+ e CD8+, ma condividono le caratteristiche dei T helper, dei T citotossici e dei linfociti NK. A differenza degli altri linfociti possono attivarsi e rispondere direttamente, senza ulteriori segnali costimolatori. Questi linfociti non riconoscono i complessi peptide-MHC, ma i fosfantigeni, delle molecole a 5 atomi di carbonio contenenti residui di fosfato, fondamentali perché consentono il riconoscimento, da parte del recettore, del fosfantigene. La produzione dei fosfantigeni avviene nella via del mevalonato; essi sono degli intermedi, come il colesterolo e l'IPP (isopentenil pirofosfato). I linfociti T γδ sono relativamente più frequenti a livello del tratto gastroenterico, dove si suppone che svolgano un'attività di regolazione della risposta immunitaria (tale funzione sembra essere persa in corrispondenza di malattie come la celiachia).
I T γδ si trovano a cavallo del confine tra immunità innata e adattativa. Da un lato, le cellule T γδ sono una componente dell'immunità adattativa essendo in grado di modificarsi per produrre una diversità del recettore e possono anche sviluppare una memoria fenoripica; d'altra parte, i vari sottogruppi fanno anche parte del sistema immunitario innato.

Linfociti B e anticorpi
Un linfocita B è in grado di identificare gli agenti patogeni, quando gli anticorpi si legano alla superficie di un antigene specifico ed estraneo al corpo. Questo complesso antigene/anticorpo viene attaccato dal linfocita B che viene degadato in peptidi da parte della proteolisi. I linfociti B, quindi, mostrano questi peptidi antigenici sulla superficie delle proprie molecole MHC di classe II. Questa combinazione tra MHC e antigene attira il linfocita T helper corrispondente, che rilascia linfochine e attiva il linfocita B. Quando il linfocita B viene attivato, esso inizia a dividersi e la sua prole (plasmacellule) secerne milioni di copie dell'anticorpo che riconosce questo antigene. Questi anticorpi circolano nel plasma sanguigno e nel sistema linfatico, si legano agli agenti patogeni che esprimono l'antigene e li segnano per la distruzione grazie all'attivazione del complemento o per l'assorbimento e la distruzione da parte dei fagociti. Gli anticorpi possono neutralizzare gli antagonisti direttamente, legandosi alle tossine batteriche o interferendo con i recettori che i virus e i batteri utilizzano per infettare le cellule.
Memoria immunologica
Quando i linfociti B e T vengono attivati e cominciano a replicarsi (selezione clonale), alcuni dei loro discendenti diventano cellule di memoria a lunga durata. Durante tutto il corso della vita di un animale, esse sono in grado di ricordare ogni agente patogeno specifico incontrato e, se l'agente viene rilevato nuovamente, può stimolare una forte risposta. Questo è un sistema "adattativo" in quanto consiste in un adattamento alle infezioni causate da quel dato patogeno e prepara il sistema immunitario ad incontrarlo in futuro. La memoria immunologica può essere sotto forma di una memoria passiva a breve termine o di una memoria attiva a lungo termine.
Memoria passiva
I neonati non hanno alcuna precedente esposizione ai microbi e sono pertanto particolarmente vulnerabili alle infezioni. Diversi livelli di protezione passiva sono forniti dalla madre. Durante la gravidanza, un particolare tipo di anticorpi, chiamati IgG, si trasferisce dalla madre al bambino direttamente attraverso la placenta, in modo che i neonati abbiano alti livelli di anticorpi, anche alla nascita, con la stessa gamma di specificità dell'antigene della propria madre. Anche il latte materno contiene anticorpi che vengono trasferiti all'intestino del neonato fornendogli protezione contro le infezioni batteriche fino a quando il neonato non sia in grado di sintetizzare i propri anticorpi. Questa è l'immunità passiva poiché il feto in realtà non produce alcuna cellula di memoria o anticorpi, prendendoli solamente in prestito. Questa immunità passiva è di solito a breve termine, che va da pochi giorni fino a diversi mesi. In medicina, la protezione da immunità passiva può anche essere trasferita artificialmente da un individuo ad un altro, tramite un siero ricco di anticorpi.
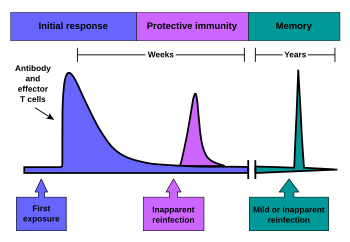
Memoria attiva e immunizzazione
La memoria attiva a lungo termine viene acquisita a seguito di un'infezione e da un'attivazione dei linfociti B e T. L'immunità attiva può anche essere generata artificialmente, attraverso la vaccinazione. Il principio alla base della vaccinazione (chiamato anche immunizzazione) è quello di introdurre un antigene di un agente patogeno al fine di stimolare il sistema immunitario e sviluppare l'immunità specifica contro quel particolare patogeno, senza però causare la malattia correlata a tale organismo. Questa induzione deliberata di una risposta immunitaria ha successo poiché sfrutta la specificità naturale del sistema immunitario, così come la sua inducibilità. Dato che la malattia infettiva è una delle principali cause di morte nella popolazione umana, la vaccinazione rappresenta la manipolazione più efficace del sistema immunitario che l'uomo ha sviluppato.
La maggior parte dei vaccini virali sono basati su virus vivi attenuati, mentre molti vaccini batterici sono basati su componenti acellulari di microrganismi, comprese delle tossine rese innocue. Poiché molti antigeni derivati da vaccini acellulari non inducono una forte risposta adattativa, i vaccini batterici sono forniti con coadiuvanti aggiuntivi che attivano le cellule che presentano l'antigene del sistema immunitario innato e massimizzano l'immunogenicità.
Immunità specifica umorale
Nella difesa specifica umorale il ruolo fondamentale spetta agli anticorpi che sono prodotti dalle plasmacellule delle cellule derivate dalle cellule clone che a loro volta sono cellule derivate dai linfociti B.
Il processo di difesa umorale inizia quando un linfocita rileva un agente esterno grazie al suo recettore specifico, ossia rileva uno ed un solo corpo esterno, (ci sono vari gruppi di linfociti B che hanno diversi recettori) e inizia la produzione di cellule clone che in parte saranno destinate alla memoria immunologica e in parte andranno a formare le plasmacellule. Le plasmacellule poi produrranno gli anticorpi che si legheranno al corpo esterno bloccando i suoi siti attivi facilitando la fagocitosi da parte dei macrofagi.
Immunità specifica cellulare
È svolta dai linfociti T citotossici, che sono capaci di indurre apoptosi nelle cellule che presentano in superficie il complesso maggiore di istocompatibilità (MHC) di classe I associato allo stesso peptide che li ha attivati. Questo significa che riconoscono tutte le cellule che "mostrano" un'espressione di MHC + peptide diversa da quella delle cellule in salute ed uguale a quella che ne ha attivato l'attività citotossica. La cellula T citotossica si attacca alla cellula bersaglio con vari recettori, rilasciando vescicole contenenti perforina, granulisina e granzimi. La perforina ha un ruolo nell'indurre la morte cellulare, contrariamente a quanto si pensava fino a pochi anni fa e cioè che servisse a generare un poro di membrana nella cellula da uccidere. La granulisina ha un'attività pro-apoptotica e microbicida. I granzimi sono serin/treonin-proteasi apoptotiche capaci di attivare la Caspasi 3 e di indurre la formazione del poro sulla membrana mitocondriale che determina la fuoriuscita del citocromo c con conseguente attivazione definitiva dell'apoptosi.
Disturbi dell'immunità umana
Il sistema immunitario è un insieme di processi notevolmente efficace che specificità, inducibilità e adattamento. Tuttavia possono verificarsi dei malfunzionamenti ed essi si possono dividere in tre grandi categorie: immunodeficienze, malattie autoimmuni e ipersensibilità.
Immunodeficienze
L'immunodeficienza si verifica quando uno o più componenti del sistema immunitario risultano inattivi. Sia nella popolazione pediatrica che in quella geriatrica, la capacità di rispondere agli agenti patogeni è minore rispetto al normale. Nei paesi sviluppati, l'obesità, l'alcolismo e l'uso di droga sono le cause più comuni di una scarsa funzione immunitaria, tuttavia, nei paesi in via di sviluppo la malnutrizione è la causa più comune di immunodeficienza. Le diete prive di un sufficiente apporto di proteine, sono correlate con un'alterata immunità cellulo-mediata, con una diminuzione dell'attività del complemento, della funzione dei fagociti, delle concentrazioni di anticorpi IgA e della produzione di citochine. Inoltre, la perdita del timo, in giovane età, per via di mutazioni genetiche o come risultato di una resezione chirurgica, comporta una grave immunodeficienza e un'elevata suscettibilità alle infezioni.
Le immunodeficienze possono essere ereditate o "acquisite". La malattia granulomatosa cronica, dove i fagociti hanno una ridotta capacità di distruggere i patogeni, è un esempio di una malattia ereditaria o congenita. L'AIDS e alcuni tipi di tumore sono causa dell'immunodeficienza acquisita.
Autoimmunità
Nella risposta autoimmune, una cellula normale può presentare un complesso proteico, prodotto dai geni MHC, e contenere una piccola sequenza aminoacidica, (8-11 aminoacidi) di natura estranea al genoma originario ereditato dai propri genitori. La sequenza aminoacidica estranea può derivare dalla sintesi proteica trascritta da geni virali integrati nel genoma stesso, o da plasmidi o da oncogeni. Questa sequenza estranea, non self, viene rilevata e segnalata alle cellule Natural Killer. I linfociti NK si attivano per la distruzione dell'intera cellula che contenendo dei geni estranei è diventata essa stessa alterata e non più self. Le cellule normali del corpo sono riconosciute e non vengono mai attaccate da macrofagi o da cellule LNK, poiché esse esprimono frammenti proteici, col MHC, sani e intatti. Ossia esprimono solo frammenti di proteine "figlie" del DNA trasmesso dai genitori. Il sistema immunitario distingue correttamente tra self e non self. In caso di presenza di proteine anomale il sistema di difesa distrugge qualunque cellula "alterata", in qualunque organo. Distrugge le cellule "infette" cercando di ottenere un così detto male minore per l’intero organismo.
Nessun anticorpo può penetrare all'interno di una cellula intatta. Solo dopo la rottura della membrana cellulare, operata dai LNK, gli anticorpi (autoanticorpi) legano ogni componente cellulare per una mera operazione di pulizia. Per esempio, il sistema immunitario può eliminare parzialmente o totalmente la tiroide dando luogo a noduli degenerativi solidi o colliquativi, può distruggere le articolazioni (artrite reumatoide), può distruggere la cute (psoriasi), può distruggere le pareti arteriose con formazione di placche aterosclerotiche (che potranno evolvere in infarti cardiaci, ictus cerebrale...), può distruggere gli epiteli intestinali (come nella malattia di Crohn, la malattia celiaca, la colite ulcerosa)...
Sono note circa 70 malattie autoimmuni. Se l'organismo non riuscisse a distruggere le proprie cellule “non più self” potrebbe dover accettare un male maggiore: il rischio di sviluppare un cancro. Infatti i geni estranei, oltre alla capacità di trascrivere per sintetizzare proteine, hanno la possibilità di usare il loro macchinario replicativo attivando la topoisomerasi e a seguire l'elicasi e i propri primer per duplicare l'intero genoma cellulare e di conseguenza l'intera cellula, questo dopo aver paralizzato gli 'oncosopressori' interni, in primis i geni p53, BRCA1 e BRCA2, Rb,...
Un trattamento solo sintomatico nelle malattie autoimmuni si avvale di farmaci immunosoppressivi e cortisonici, mentre alcuni farmaci antivirali potrebbero costituire una terapia causale.
Ipersensibilità
Le reazioni di ipersensibilità sono una risposta immunitaria che danneggia i tessuti del corpo. Esse sono suddivise in quattro classi (dal tipo I al tipo IV) basate sui meccanismi coinvolti e dal loro decorso. L'ipersensibilità di tipo I è una reazione immediata o anafilattica, spesso associata con l'allergia. I sintomi possono variare da un leggero fastidio fino al decesso. L'ipersensibilità di tipo I è mediata dagli IgE, che innescano la degranulazione dei mastociti e dei basofili, quando sono legate ad un antigene. L'ipersensibilità di tipo II si verifica quando gli anticorpi si legano agli antigeni sulle cellule del paziente, contrassegnandoli per la distruzione. Questa viene chiamata anche ipersensibilità anticorpo-dipendente (o citotossica), ed è mediata dagli anticorpi IgG e IgM. I complessi immuni (aggregazioni di antigeni, proteine del complemento e anticorpi IgG e IgM) depositati nei vari tessuti innescano reazioni di ipersensibilità di tipo III. L'ipersensibilità di tipo IV (nota anche come cellulo-mediata o ipersensibilità di tipo ritardato) di solito impiega tra due e tre giorni di tempo per svilupparsi. Le reazioni di tipo IV sono coinvolte in molte malattie autoimmuni e infettive, ma può anche comportare una dermatite da contatto. Queste reazioni sono mediate dai linfociti T, dai monociti e dai macrofagi.
Altri meccanismi e l'evoluzione
È probabile che un sistema immunitario adattativo multicomponente, sia nato con i primi vertebrati, in quanto gli invertebrati non sono in grado di produrre linfociti o una risposta umorale basata sugli anticorpi. Molte specie, tuttavia, utilizzano alcuni meccanismi che sembrano essere precursori di alcuni aspetti dell'immunità dei vertebrati. Un sistema immunitario appare anche nelle strutturalmente più semplici forme di vita; i batteri possiedono un unico meccanismo di difesa, chiamato "sistema di resitrizione-modificazione" per proteggersi dagli agenti patogeni virali, chiamati batteriofagi. I procarioti possiedono anche un'immunità acquisita, attraverso un sistema che utilizza sequenze CRISPR per conservare frammenti del genoma del batteriofago di cui è venuto precedentemente in contatto, che consente a loro di bloccare la replicazione del virus attraverso una forma di interferenza dell'RNA. Elementi offensivi del sistema immunitario sono presenti anche negli eucarioti unicellulari, ma vi sono pochi studi che analizzano il loro ruolo.
I recettori di riconoscimento di pattern sono proteine utilizzate da quasi tutti gli organismi per identificare le molecole associate ai patogeni. I peptidi antimicrobici, chiamati defensine, sono una componente evolutivamente conservata della risposta immunitaria innata che si trova in tutti gli animali e in tutte le piante, costituendo la principale forma di immunità sistemica degli invertebrati. Il sistema del complemento e i fagociti, sono utilizzati anche dalla maggior parte delle forme di vita invertebrata. La ribonucleasi e il percorso dell'interferenza dell'RNA si sono conservati in tutti gli eucarioti e si ritiene che possano svolgere un ruolo nella risposta immunitaria ai virus.
A differenza degli animali, le piante sono prive di fagociti, ma le risposte immunitarie di molti vegetali coinvolgono segnali chimici sistemici che vengono inviati attraverso una struttura. Le cellule vegetali individuali rispondono alle molecole associate a patogeni noti come modelli grazie ai profili molecolari associati ai patogeni (o PAMP, da Pathogen Associated Molecular Patterns). Quando una parte di una pianta si infetta, essa produce una risposta ipersensibile localizzata, per cui le cellule nel sito di infezione subiscono una rapida apoptosi al fine di prevenire la diffusione della malattia in altre parti di essa. La resistenza sistemica acquisita (SAR) è un tipo di risposta difensiva utilizzata dalle piante e che la rende resistente a un particolare agente infettivo. I meccanismi di silenziamento dell'RNA sono particolarmente importanti in questa risposta sistemica in quanto possono bloccare la replicazione del virus.
Immunologia dei tumori

Un altro ruolo importante del sistema immunitario è quello di identificare ed eliminare i tumori. Questo compito è chiamato sorveglianza immunitaria. Le mutate cellule tumorali esprimono antigeni che non si trovano sulle cellule normali. Per il sistema immunitario, questi antigeni appaiono estranei e la loro presenza induce i linfociti ad attaccarle. Gli antigeni espressi dai tumori hanno diverse fonti; alcuni sono derivati dai virus oncogeni, come il papillomavirus umano causa del tumore cervicale, mentre altri sono proteine proprie dell'organismo che vengono prodotte a bassi livelli nelle cellule normali ma raggiungono alti livelli in quelle tumorali. Un esempio, è l'enzima tirosinasi che quando viene espresso ad alti livelli, trasforma alcune cellule della pelle (ad esempio i melanociti) in neoplasie chiamate melanomi. Una terza possibile fonte di antigeni tumorali sono le proteine che normalmente sono importanti per la regolazione della crescita cellulare e per la sopravvivenza, che frequentano mutano in molecole che inducono i tumori, chiamate oncogeni.
La principale risposta del sistema immunitario ai tumori consiste nella distruzione delle cellule anormali, utilizzando i linfociti T killer, talvolta con l'assistenza dei linfociti T helper. Gli antigeni tumorali sono presentati sulle molecole MHC di classe I in un modo simile agli antigeni virali. Questo permette ai linfociti T killer di riconoscere la cellula tumorale come anormale. Anche i linfociti NK sono in grado di uccidere le cellule tumorali in modo simile, soprattutto se queste presentano meno molecole MHC di classe I sulla loro superficie del normale; questo è un fenomeno comune nei tumori. A volte gli anticorpi vengono generati contro le cellule tumorali per consentire la loro distruzione da parte del sistema del complemento.
Chiaramente, alcune cellule mutate eludono il sistema immunitario e progrediscono dando luogo alle neoplasie. Le cellule tumorali spesso hanno un ridotto numero di molecole MHC di classe I sulla loro superficie, evitando in tal modo il rilevamento da parte dei linfociti T killer. Alcune cellule tumorali rilasciano anche prodotti che inibiscono la risposta immunitaria; per esempio secernendo la citochina TGF-β, che sopprime l'attività dei macrofagi e dei linfociti. Inoltre, può svilupparsi una tolleranza immunologica contro gli antigeni tumorali, così che il sistema immunitario non riesca ad attaccare le cellule neoplastiche.
Paradossalmente, i macrofagi possono promuovere la crescita neoplastica; questo avviene quando le cellule tumorali inviano citochine che attirano i macrofagi, che poi essi stessi generano citochine e fattori di crescita che alimentano lo sviluppo del tumore. Inoltre, una combinazione dell'ipossia nel tumore e una citochina prodotta dai macrofagi, induce le cellule tumorali a diminuire la produzione di una proteina che blocca la metastasi e quindi aumenta la diffusione delle cellule tumorali.
Regolazione fisiologica
Gli ormoni possono agire come immunomodulatori, alterando la sensibilità del sistema immunitario. Ad esempio, gli ormoni sessuali femminili sono noti per essere immunostimolanti sia della risposta adattiva che della risposta innata.. Alcune malattie autoimmuni, come il lupus eritematoso colpiscono preferenzialmente le donne e il loro esordio coincide spesso con la pubertà. Per contro, gli ormoni sessuali maschili, come il testosterone, sembrano essere immunosoppressivi. Si pensa che anche altri ormoni siano in grado di regolare il sistema immunitario, in particolare la prolattina, l'ormone della crescita e la vitamina D.
Quando un linfocita T incontra un agente patogeno esterno, estende un recettore della vitamina D. Questo è essenzialmente un dispositivo di segnalazione che permette ai linfociti T di legarsi alla forma attiva della vitamina D, lo steroide dell'ormone calcitriolo. I linfociti T hanno un rapporto simbiotico con la vitamina D, infatti non solo estendono il recettore per essa, ma esprimono anche il gene CYP27B1, che è il gene responsabile per la conversione della versione pre-ormone della vitamina D, il calcidiolo, nella versione ormone steroideo, il calcitriolo. Solo dopo che si forma il legame con calcitriolo, i linfociti T possono svolgere la loro funzione prevista. Altre cellule del sistema immunitario note per esprimere il gene CYP27B1 e quindi attivare la vitamina D calcidiolo, sono le cellule dendritiche, i cheratinociti e i macrofagi.
Si ritiene che un progressivo declino dei livelli ormonali con l'avanzare dell'età, sia parzialmente responsabile per l'indebolimento della risposta immunitaria che si riscontra negli individui anziani. Al contrario, alcuni ormoni sono regolati dal sistema immunitario, in particolare l'attività dell'ormone tiroideo. Il declino relativo all'età nella funzione immunitaria è anche legato alla diminuzione dei livelli di vitamina D negli anziani. Con l'invecchiamento accadono due eventi che possono influenzare negativamente i propri livelli di vitamina D. In primo luogo, essi tendenzialmente rimangono maggiormente in casa per via di un'attività motoria ridotta e questo significa che prendono meno sole, producendo quindi meno colecalciferolo tramite le radiazioni ultraviolette. In secondo luogo, la cute di una persona anziana diventa meno abile nel produrre vitamina D.
Sonno e riposo
Il sistema immunitario viene influenzato dal sonno e dal riposo, infatti si è dimostrato che la privazione del sonno è dannosa per la funzione immunitaria. Un complesso sistema di feedback e loop che coinvolge citochine, come l'interleuchina 1 e il fattore di necrosi tumorale-α, prodotte in risposta alle infezioni, sembra svolgere un ruolo nella regolazione della fase non-rapid eye movement (REM) del sonno. Così la risposta immunitaria alle infezioni può comportare modifiche al ciclo del sonno, tra cui un aumento del sonno a onde lente rispetto al sonno REM.
Quando si soffre di privazione del sonno, le vaccinazioni attive possono avere una diminuzione dell'effetto provocando una ridotta produzione di anticorpi e una risposta immunitaria meno efficiente, rispetto a quella che si osserverebbe in un individuo ben riposato. Inoltre, proteine come NFIL3, che hanno dimostrato di essere strettamente correlate sia con la differenziazione dei linfociti T che con i ritmi circadiani, possono essere influenzate attraverso il disturbo dei cicli di luce naturale per via della privazione del sonno, dei lavori a turni, ecc. Come di conseguenza, ciò può portare all'aumento delle patologie croniche, come le malattie cardiache, il dolore cronico e l'asma.
Oltre alle conseguenze negative della privazione del sonno, lo stravolgimento del sistema circadiano ha dimostrato di avere forti effetti regolatori sulle funzioni immunologiche che interessano sia l'immunità innata che quella adattativa. In primo luogo, durante la fase iniziale del sonno ad onde lente, un calo improvviso dei livelli ematici di cortisolo, adrenalina e noradrenalina inducono un aumento dei livelli ematici degli ormoni leptina, dell'ormone ipofisario della crescita e della prolattina. Questi segnali inducono uno stato pro-infiammatorio, per via della produzione di citochine interleuchina 1, interleuchina-12, TNF-alfa e interferone gamma. Queste citochine poi stimolano le funzioni immunitarie come l'attivazione delle cellule immunitarie, la loro proliferazione e la differenziazione.
Durante i periodi di veglia, le cellule effettrici differenziate, come i linfociti citotossici natural killer e i linfociti T citotossici, presentano un picco di attività in modo da ottenere una risposta efficace contro eventuali agenti patogeni intrusi. Vi sono due teorie che cercano di spiegare perché lo stato pro-infiammatorio è riservato al tempo di sonno. La prima considera che se l'infiammazione si verificasse durante i periodi di veglia, causerebbe gravi menomazioni cognitive e fisiche, mentre la seconda considera la presenza della melatonina nei periodi di sonno. L'infiammazione provoca una grande quantità di stress ossidativo e la presenza di melatonina durante i periodi di sonno potrebbe contrastare attivamente la produzione di radicali liberi durante questo periodo.
Nutrizione e dieta
Apporti nutritivi troppo elevati, sono correlati con malattie come il diabete e l'obesità che sono note per influenzare la funzione immunitaria. Anche una cattiva dieta, così come alcune carenze di minerali ed elementi nutrizionali specifici, può essere causa di una compromissione della risposta immunitaria.
Gli alimenti ricchi di alcuni acidi grassi possono essere promotori di un sistema immunitario sano. Analogamente, una denutrizione fetale può causare un danno permanente al sistema.
Fattori ambientali
Diversi studi hanno dimostrato che l'inquinamento può influenzare negativamente il sistema immunitario.
Manipolazione in medicina

La risposta immunitaria può essere manipolata per sopprimere le risposte indesiderate derivanti dalle malattie autoimmuni, dalle allergie e dal rigetto di trapianto e per stimolare le risposte di protezione contro gli agenti patogeni che in gran parte sfuggono al sistema immunitario o ai tumori.
Immunosoppressione
Farmaci immunosoppressori vengono usati per controllare i disordini autoimmuni o l'infiammazione quando si verifica un eccessivo danno tissutale, oltre che per prevenire il rigetto del trapianto dopo aver subito un trapianto d'organo.
Farmaci antinfiammatori sono spesso utilizzati per controllare gli effetti dell'infiammazione, tra questi, i glucocorticoidi sono i più potenti; tuttavia questi farmaci possono avere molti effetti collaterali indesiderati, come obesità addominale, iperglicemia, osteoporosi, dunque il loro uso deve essere controllato scrupolosamente. Basse dosi di farmaci anti-infiammatori sono spesso usati in combinazione con farmaci citotossici o immunosoppressivi, come il metotrexato o l'azatioprina. I farmaci citotossici inibiscono la risposta immunitaria uccidendo le cellule in divisione, come i linfociti T attivati. Tuttavia, vengono uccise indiscriminatamente le cellule che si dividono e altri organi vengono colpiti, provocando effetti collaterali tossici. I farmaci immunosoppressori, come la ciclosporina, evitano che i linfociti T rispondano ai segnali correttamente inibendo le vie di trasduzione del segnale.
Immunostimolazione
La terapia con anticorpi monoclonali stimola il sistema immunitario ad attaccare le cellule del tumore.
Bibliografia
- Charles A. Janeway, Paul Travers, Mark Walport, Mark J. Shlomchik, Immunobiologia (3ª edizione italiana sulla 6ª inglese), Padova, Piccin, 2007, ISBN 88-299-1814-8.
- (EN) Charles Janeway, Immunobiology, 6th, Garland Science, 2005, ISBN 0-443-07310-4.
- (EN) Viera Stvrtinová, Ján Jakubovský e Ivan Hulín, Inflammation and Fever from Pathophysiology: Principles of Disease, Computing Centre, Slovak Academy of Sciences, Academic Electronic Press, 1995, ISBN 80-967366-1-2. URL consultato il 1º gennaio 2007 (archiviato dall'url originale l'11 luglio 2001).
- (EN) Kenneth Murphy e Casey Weaver, 10: The Humoral Immune Response, in Immunobiology, 9ª ed., Garland Science, 2016, ISBN 978-0-8153-4505-3.
- (EN) CR Wira, Crane-Godreau M e Grant K, Endocrine regulation of the mucosal immune system in the female reproductive tract, in Mucosal Immunology, San Francisco, Elsevier, 2004, ISBN 0-12-491543-4.
- (EN) Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts e Peter Walters, Molecular Biology of the Cell, Fourth, New York and London, Garland Science, 2002, ISBN 978-0-8153-3218-3.
- Alberto Mantovani, Il fuoco interiore. Il sistema immunitario e l'origine delle malattie. Nuova ediz., Mondadori, 2021, ISBN 978-88-04-73686-8. URL consultato il 19 dicembre 2022.
Voci correlate
- Malattie del sistema immunitario
- Antigene
- Anticorpo
- Infezione
- Immunosenescenza
- Teoria della selezione clonale
- HLA-B
- Sistema immunitario artificiale
Altri progetti
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file sul sistema immunitario
Wikimedia Commons contiene immagini o altri file sul sistema immunitario
Collegamenti esterni
- immunitàrio, sistèma, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) Sistema immunitario, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Sistema immunitario, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana.
| Controllo di autorità | Thesaurus BNCF 5131 · LCCN (EN) sh86006453 · GND (DE) 4026643-6 · BNF (FR) cb12098530j (data) · J9U (EN, HE) 987007565934605171 |
|---|