
Malattia di Parkinson
| Malattia di Parkinson | |
|---|---|
 | |
| Specialità | neurologia |
| Classificazione e risorse esterne (EN) | |
| OMIM | 168600 |
| MeSH | D010300 |
| MedlinePlus | 000755 |
| eMedicine | 1831191 |
| GeneReviews | Panoramica |
| Sinonimi | |
| Morbo di Parkinson Parkinson Parkinsonismo idiopatico Parkinsonismo primario Sindrome ipocinetica rigida Paralisi agitante | |
| Eponimi | |
| James Parkinson | |
La malattia di Parkinson, sovente definita come morbodi Parkinson, Parkinson, parkinsonismo idiopatico, parkinsonismo primario, sindrome ipocinetica rigida o paralisi agitante è una malattia neurodegenerativa.
I sintomi motori tipici della condizione sono il risultato della morte delle cellule che sintetizzano e rilasciano la dopamina. Tali cellule si trovano nella substantia nigra, una regione del mesencefalo. La causa che porta alla loro morte è sconosciuta. All'esordio della malattia i sintomi più evidenti sono legati al movimento, ed includono tremori a riposo, rigidità, lentezza nei movimenti (bradicinesia) ed instabilità nell'equilibrio. Affinché possa essere ipotizzata la diagnosi di Parkinson, almeno tre di questi sintomi 'cardine' devono essere presenti; il tremore non è infatti presente in tutti i pazienti. Inoltre, i sintomi si presentano in modo asimmetrico (un lato del corpo è più interessato dell'altro). All'esordio della malattia, spesso i sintomi non vengono riconosciuti immediatamente poiché si manifestano in modo subdolo e incostante e la progressione della malattia è tipicamente lenta. La malattia di Parkinson è più comune negli anziani; la maggior parte dei casi si verifica dopo i 50 anni, ma le statistiche danno evidenza che la casistica è in aumento e che l'età si sta abbassando.
La malattia è spesso definita come una sindrome idiopatica, anche se alcuni casi atipici hanno un'origine genetica. Molti fattori di rischio e fattori protettivi sono stati indagati: ad esempio, l'aumento del rischio di contrarre la malattia nelle persone esposte ad idrocarburi, solventi e pesticidi. La patologia è caratterizzata dall'accumulo di una proteina, chiamata α-sinucleina, in inclusioni denominate corpi di Lewy nei neuroni e dall'insufficiente formazione di dopamina. La distribuzione anatomica dei corpi di Lewy è spesso direttamente correlata all'espressione e al grado dei sintomi clinici di ciascun individuo.
La diagnosi nei casi tipici si basa principalmente sui sintomi, con indagini di neuroimaging come conferma. I moderni trattamenti sono efficaci per gestire i sintomi motori precoci della malattia, grazie all'uso di agonisti della dopamina e della L-dopa (levodopa). Col progredire della malattia, i neuroni dopaminergici continuano a diminuire di numero ed è quindi necessario aumentare il dosaggio dei farmaci, che possono però generare complicanze, quali la discinesia, caratterizzata da movimenti involontari, oppure la distonia, consistente in contratture muscolari dolorose. Una corretta alimentazione e alcune forme di riabilitazione, in particolare la fisiochinesiterapia, si sono dimostrati efficaci nel contrastare la progressione della malattia. La stimolazione cerebrale profonda o DBS - Deep Brain Stimulation - è una delle soluzioni chirurgiche che può essere utilizzata per attenuare alcuni sintomi come l'eccessivo tremore o normalizzare le fluttuazioni motorie, nei casi in cui la soluzione farmacologica da sola non sia più sufficiente.
La malattia prende il nome dal medico inglese James Parkinson, che pubblicò la prima descrizione dettagliata nel suo trattato An Essay on the Shaking Palsy nel 1817.
Diverse importanti organizzazioni promuovono la ricerca e il miglioramento della qualità della vita delle persone affette dalla malattia. Alcuni pazienti famosi, come l'attore Michael J. Fox, il pugile Muhammad Ali, papa Giovanni Paolo II, il ciclista Davis Phinney, i cantanti Alex Band, Peter Hofmann, Bruno Lauzi e il giornalista Vincenzo Mollica, hanno fatto crescere la consapevolezza della malattia nella società.
Indice
Storia

Diverse fonti antiche, tra cui un papiro egiziano, un trattato di medicina Ayurveda, la Bibbia e gli scritti di Galeno, descrivono sintomi simili a quelli della malattia di Parkinson. Dopo Galeno e fino alla fine del XVII secolo, non vi sono altri riferimenti chiari relativi alla malattia. Nei secoli successivi, diversi autori hanno documentato le varie caratteristiche della malattia. Tra di essi ricordiamo: Franciscus Sylvius, Hieronymus David Gaubius, John Hunter e Auguste François Chomel.
Nel 1817 un medico inglese, James Parkinson, pubblicò un saggio in cui segnalava sei casi di paralisi agitante. Parkinson descrisse il caratteristico tremore a riposo, la postura e l'andatura anomala, la paralisi, la diminuzione della forza muscolare e il modo in cui la condizione progredisce nel tempo. I primi neurologi che hanno contribuito a comprendere meglio la malattia, comprendono Armand Trousseau, William Richard Gowers, Samuel Alexander Kinnier Wilson, Wilhelm Heinrich Erb e più in particolare Jean-Martin Charcot, i cui studi effettuati tra il 1868 e il 1881 sono stati un punto di riferimento nella sua comprensione. Tra le varie scoperte, a Charcot va attribuito il merito di aver compiuto la distinzione tra la rigidità, la debolezza e la bradicinesia. Egli ha anche sostenuto la ridenominazione della malattia in onore di James Parkinson.
Nel 1912, Frederic Lewy descrisse le particelle microscopiche nel cervello colpito dalla malattia, poi chiamate "corpi di Lewy". Nel 1919, Konstantin Tretiakoff scoprì che la substantia nigra è la principale struttura cerebrale colpita, ma questa scoperta non fu ampiamente accettata fino a quando non è stata confermata da successivi studi pubblicati da Rolf Hassler nel 1938. I cambiamenti biochimici alla base del cervello sono stati individuati nel 1950, grazie soprattutto al lavoro di Arvid Carlsson sul neurotrasmettitore dopamina e sull'identificazione del suo ruolo nella malattia. Nel 1997, l'alfa-sinucleina è risultata essere il principale componente dei corpi di Lewy.
La somministrazione di anticolinergici e la chirurgia (lesione della via cortico-spinale o di alcune delle strutture dei gangli della base) sono stati i trattamenti utilizzati fino all'introduzione del farmaco levodopa, che ha ridotto drasticamente il loro uso. La levodopa è stata sintetizzata nel 1911 da Kazimierz Funk, ma ricevette poca attenzione fino alla metà degli anni venti. Entrò successivamente nella pratica clinica nel 1967, portando una rivoluzione nella gestione della malattia. Dalla fine del 1980 la stimolazione cerebrale profonda viene considerata come un possibile trattamento.
Epidemiologia
La malattia di Parkinson è la seconda malattia neurodegenerativa più comune dopo la malattia di Alzheimer. La prevalenza della condizione nei paesi industrializzati è di circa lo 0,3%. La malattia di Parkinson è più comune negli anziani e la prevalenza aumenta dall'1% in quelli oltre i 60 anni di età, fino al 4% della popolazione sopra gli 80 anni. L'età media di insorgenza è circa 60 anni, anche se il 5-10% dei casi, classificati come ad esordio giovane, iniziano tra i 20 e i 50 anni. La malattia risulterebbe essere meno diffusa nelle popolazioni di origine africana e asiatica, sebbene questo dato sia contestato. Alcuni studi hanno proposto che sia più comune negli uomini rispetto alle donne, ma altri non hanno rilevato particolari differenze tra i due sessi. L'incidenza della malattia di Parkinson è tra 8 e 18 per 100 000 persone-anno.
Fattori di rischio

Molti fattori di rischio e molti fattori protettivi sono stati proposti, a volte in relazione alle teorie riguardanti i possibili meccanismi della malattia, ma nessuno è stato definitivamente individuato da prove certe. Quando gli studi epidemiologici sono stati condotti per verificare la relazione tra un dato fattore e la malattia di Parkinson, spesso i risultati sono apparsi contraddittori. Le correlazioni più frequentemente proposte per aumentarne il rischio, sono quelle in cui viene coinvolta l'esposizione ai fitofarmaci e idrocarburi solventi, mentre sembra esserci una riduzione del rischio nei fumatori.
Iniezioni della neurotossina MPTP sintetica producono una serie di sintomi simili a quelli della malattia di Parkinson, essi possono essere bloccati interrompendo l'assunzione di tale sostanza. L'osservazione di questo fenomeno ha portato a teorizzare che l'esposizione ad alcune tossine ambientali possa aumentare il rischio di sviluppare la condizione. Le tossine che sono state correlate alla malattia e ritenute in grado di aumentare del doppio il rischio di soffrirne, comprendono alcuni insetticidi, come il rotenone, e erbicidi, come il disseccante paraquat e il defoliante Agente Arancio. Le misure indirette dell'esposizione, come quelle effettuate su persone che vivono in ambienti rurali, hanno evidenziato un aumento del rischio di sviluppare la malattia di Parkinson. Anche l'esposizione ai metalli pesanti è stata proposta come fattore di rischio per la malattia, attraverso il possibile accumulo nella substantia nigra, tuttavia gli studi sull'argomento si sono rivelati inconcludenti.
Alcuni studi hanno messo in correlazione il verificarsi di ripetuti traumi cranici e lo sviluppo della malattia. Si sospetta che i pugili professionisti, a seguito dei violenti colpi al capo cui sono soggetti, possano sviluppare una sindrome di Parkinson di carattere progressivo (il caso di Cassius Clay ne potrebbe essere una dimostrazione). Uno studio compiuto su praticanti boxe thailandese ritirati, ha evidenziato un aumento del rischio.
Da non trascurare, infine, l'ipotesi legata all'età. La malattia presenta un picco di insorgenza attorno ai sessant'anni, e nell'adulto sano la perdita di cellule e pigmento nella sostanza nera è maggiore proprio intorno al sessantesimo anno d'età. Viene meno così la protezione delle cellule contenenti dopamina e il cervello delle persone anziane è, inevitabilmente, più predisposto al Parkinson. Si ritiene, inoltre, che disturbi psichiatrici, come la depressione, siano un ulteriore fattore di rischio per la malattia.
Secondo i dati elaborati da uno studio pubblicato nel 2011, tra le sostanze organiche che aumentano il rischio di sviluppare la patologia in caso di prolungata esposizione vi sono il tricloroetilene, il percloroetilene e il tetracloruro di carbonio.
Fattori di protezione

È stato dimostrato che il consumo di caffeina è in grado di proteggere dalla malattia di Parkinson. Studi epidemiologici condotti su un ampio campione (374 003 soggetti) hanno evidenziato che il rischio di sviluppare la condizione diminuisce progressivamente con il consumo di caffè e di altri alimenti contenenti caffeina. Sebbene il fumo di tabacco sia devastante per la longevità e per la qualità della vita, è stato correlato ad una diminuzione del rischio di avere la malattia. Tale rischio, nei fumatori, può arrivare ad essere minore fino a un terzo rispetto ai non fumatori. Il motivo di ciò non è noto con certezza, ma si ritiene che la nicotina possa avere un effetto stimolante sulla dopamina. Il fumo di tabacco contiene composti che agiscono come inibitori della monoamino ossidasi che potrebbero anche loro contribuire a questo effetto. Gli antiossidanti, come le vitamine C e D, sono stati proposti come sostanze protettive dalla malattia, ma i risultati degli studi sono stati contraddittori e nessun effetto positivo è stato dimostrato. Anche gli studi sull'assunzione di acidi grassi e grassi alimentari non hanno portato a risultati chiari. Infine, vi sono state indicazioni preliminari di un possibile ruolo protettivo degli estrogeni e dei farmaci anti-infiammatori non steroidei.
Patogenesi
Anatomia patologica

I nuclei della base, un gruppo di strutture cerebrali innervate dal sistema dopaminergico, sono le aree cerebrali più colpite nella malattia di Parkinson. La principale caratteristica patologica della condizione è la morte delle cellule nella substantia nigra e, più specificamente, nella parte ventrale (anteriore) della pars compacta, causando nel tempo la morte delle cellule fino al 70% del loro totale.
Al taglio del tronco cerebrale, si possono notare alterazioni macroscopiche in cui la perdita neuronale si può dedurre da una riduzione della pigmentazione della melanina nella substantia nigra e nel locus coeruleus. L'istopatologia (anatomia microscopica) della substantia nigra e delle diverse regioni cerebrali, mostra una perdita neuronale e corpi di Lewy in molte delle cellule nervose rimanenti. La perdita neuronale è accompagnata da morte degli astrociti (cellule gliali a forma di stella) e l'attivazione delle microglia (un altro tipo di cellule gliali). I corpi di Lewy sono un elemento patologico chiave nella malattia di Parkinson.
Fisiopatologia


B. Localizzazione della zona di significativa riduzione del volume cerebrale nella fase iniziale della malattia rispetto ad un gruppo di partecipanti sani ad uno studio di neuroimaging, che ha concluso che il danno al tronco cerebrale può essere la prima tappa identificabile della malattia di Parkinson.
I sintomi principali della malattia di Parkinson sono il risultato di un'attività molto ridotta delle cellule secernenti dopamina, causata dalla morte cellulare nella regione pars compacta della substantia nigra.
Nel cervello vi sono cinque circuiti principali che collegano le aree cerebrali ai gangli basali. Questi circuiti sono noti come: circuito motorio, circuito oculomotore, circuito associativo, circuito limbico e circuito orbitofrontale, con nomi che indicano le principali aree che vengono servite da ogni circuito. Nella malattia di Parkinson, tutti i circuiti elencati possono venire influenzati e ciò spiega molti dei sintomi. Infatti, una varietà di funzioni sono controllate da questi circuiti, tra le quali quelle del movimento, dell'attenzione e dell'apprendimento. Dal punto di vista scientifico, il circuito motorio è quello che è stato studiato con maggiore attenzione.
Un particolare modello concettuale del circuito motorio e del suo coinvolgimento nella malattia è stato, a partire dal 1980, di grande influenza, anche se nel tempo sono stati sollevati alcuni dubbi che hanno portato a modificarlo. In questo modello, i gangli della base normalmente esercitano una costante influenza inibitoria su una vasta gamma di sistemi motori, impedendo loro di attivarsi nei momenti inopportuni. Quando si decide di effettuare una determinata azione, l'inibizione viene ridotta. La dopamina agisce per facilitare questo cambiamento nell'inibizione: livelli elevati di dopamina tendono a promuovere l'attività motoria, mentre bassi livelli, come avviene nella malattia, richiedono maggiori sforzi per compiere un dato movimento. Così l'effetto reale della deplezione di dopamina è il verificarsi dell'ipocinesia, una riduzione complessiva dell'uscita dei segnali motori. I farmaci che vengono usati per trattare la malattia di Parkinson, viceversa, tendono a produrre una quantità troppo elevata di dopamina, portando i sistemi motori ad attivarsi nel momento non appropriato e causando pertanto discinesia.
Morte delle cellule cerebrali
Vi sono diversi meccanismi proposti per cui le cellule cerebrali, nella malattia, vanno incontro alla morte. Uno di questi prevede che un accumulo anomalo della proteina alfa-sinucleina, legata alla ubiquitina, danneggi le cellule. Questa proteina insolubile si accumula all'interno dei neuroni formando delle inclusioni, chiamate corpi di Lewy. Secondo la stadiazione di Braak, una classificazione della malattia sulla base del quadro patologico, i corpi di Lewy prima appaiono nel bulbo olfattivo, nel midollo allungato e nel tegmento pontino, con i pazienti che risultano asintomatici. Col progredire della malattia, i corpi di Lewy si sviluppano nella substantia nigra, nelle aree del mesencefalo e prosencefalo basale e, nell'ultima fase, nella neocorteccia. Queste zone del cervello sono le aree principali della degenerazione neuronale nella malattia di Parkinson. Tuttavia, i corpi di Lewy non possono essere la causa diretta della morte delle cellule. Nei pazienti con demenza una presenza generalizzata dei corpi di Lewy è comune nelle aree corticali. Ammassi neurofibrillari e placche senili, riscontrabili caratteristicamente nella malattia di Alzheimer, non sono comuni a meno che il paziente non presenti una forma di demenza.
Altri meccanismi che portano alla morte cellulare includono la disfunzione dei sistemi lisosomiali e proteosomiali e una ridotta attività mitocondriale. L'accumulo di ferro nella substantia nigra si osserva tipicamente in combinazione con le inclusioni proteiche. Ciò può essere correlato allo stress ossidativo, all'aggregazione proteica e alla morte neuronale, ma i meccanismi che regolano questo fenomeno non sono pienamente compresi.
Eziologia
La maggior parte delle persone con malattia di Parkinson presenta una condizione idiopatica (che non ha una causa specifica nota). Una piccola percentuale di casi, tuttavia, può essere attribuita a fattori genetici conosciuti. Altri fattori sono stati associati con il rischio di sviluppare la malattia, ma non sono state dimostrate relazioni causali.
La malattia di Parkinson è stata tradizionalmente considerata una malattia non genetica. Tuttavia, circa il 15% degli individui con malattia di Parkinson ha un parente di primo grado con la stessa condizione. Almeno il 5% delle persone è ormai noto per avere forme della malattia che si verifica a causa di una mutazione di uno dei numerosi geni specifici.

È stato dimostrato in modo definitivo che le mutazioni in geni specifici possono essere causa della malattia. Questi geni codificano per alfa-sinucleina (SNCA), parkina (PRKN), dardarina (LRRK2), PTEN chinasi indotta putativo 1 (PINK1), DJ-1 e ATP13A2. Nella maggior parte dei casi, le persone con queste mutazioni svilupperanno la malattia di Parkinson. Con l'eccezione di LRRK2, tuttavia, rappresentano solo una piccola minoranza dei casi della malattia. I geni correlati alla condizione e maggiormente studiati sono SNCA e LRRK2. Le mutazioni nei geni tra cui SNCA, LRRK2 e glucocerebrosidasi (GBA) sono stati individuati come fattori di rischio nello sviluppo della malattia di Parkinson. Le mutazioni in GBA sono note per causare la malattia di Gaucher.
Il ruolo del gene SNCA è importante in quanto l'alfa-sinucleina alfa è il componente principale dei corpi di Lewy.Mutazioni missenso del gene (in cui un singolo nucleotide viene cambiato) e duplicazioni e triplicazioni del locus che lo contiene, sono state trovate in diversi gruppi aventi familiari affetti dalla malattia di Parkinson. Le mutazioni missenso sono rare. Tuttavia, moltiplicazioni del locus SNCA rappresentano circa il 2% dei casi familiari.
Il gene LRRK2 (PARK8) codifica per una proteina chiamata dardarina. Il nome dardarina è stato coniato da una parola basca che sta per tremore, poiché questo gene è stato identificato in famiglie provenienti dall'Inghilterra e dal nord della Spagna. Le mutazioni nel LRRK2 sono la causa più comune conosciuta di malattia di Parkinson famigliare e sporadica, esse rappresentano circa il 5% degli individui con una storia familiare della malattia e il 3% dei casi sporadici. Vi sono molte differenti mutazioni descritte in LRRK2, la prova inequivocabile di causalità esiste, tuttavia, solo per un piccolo numero.
Sindromi parkinsoniane
Sono sindromi somiglianti alla malattia di Parkinson, ma a diversa eziologia (ad esempio uso di farmaci antipsicotici), tranne i parkinsonismi monogenici famigliari che possono essere assimilati al vero Parkinson idiopatico o multifattoriale, pur essendo un gene singolo a causarli.
Segni e sintomi
La malattia di Parkinson colpisce prevalentemente il movimento, producendo sintomi motori. Sintomi non motori, che comprendono insufficienza autonomica, problemi neuropsichiatrici (alterazioni dell'umore, della cognizione, del comportamento o del pensiero), difficoltà sensoriali e del sonno, sono anch'essi comuni.
Movimento

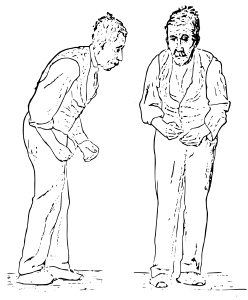
Quattro caratteristiche motorie sono considerate come la base sintomatologica della malattia di Parkinson: il tremore, la rigidità, la bradicinesia e l'instabilità posturale.
Il tremore è il sintomo più evidente e più comune, anche se circa il 30% degli individui con malattia di Parkinson all'esordio non lo mostra. Il tremore è tipicamente "a riposo", con bassa frequenza, scompare durante i movimenti volontari e in genere peggiora nelle situazioni di stress emozionale, mentre è assente durante il sonno. Esso coinvolge maggiormente la porzione più distale dell'arto e all'insorgenza appare tipicamente in un unico braccio o gamba, divenendo successivamente bilaterale. La frequenza del tremore parkinsoniano è compresa tra i 4 e 6 hertz (cicli al secondo) ed è descritto come l'atto di "contare le monete" o come pill-rolling, un termine che deriva dalla somiglianza tra il movimento nei pazienti e la tecnica utilizzata in farmaceutica per preparare manualmente le pillole.
La bradicinesia (lentezza dei movimenti) è un'altra caratteristica della malattia ed è associata a difficoltà in tutto il processo del movimento, dalla pianificazione alla iniziazione e, infine, all'esecuzione. Il movimento sequenziale e simultaneo viene ostacolato. La bradicinesia è il sintomo più invalidante nei primi stadi della malattia. Queste manifestazioni comportano diversi problemi durante l'esecuzione delle attività quotidiane che richiedono un controllo preciso dei movimenti, come la scrittura, il cucito o il vestirsi. La valutazione clinica si basa su prove riguardanti operazioni simili. La bradicinesia non è uguale per tutti i movimenti, alcuni pazienti risultano in grado di camminare con grandi difficoltà, ma tuttavia riescono ancora ad andare in bicicletta. Generalmente gli individui che presentano bradicinesia mostrano difficoltà minori se gli vengono forniti degli ausili.

La rigidità e la resistenza al movimento degli arti è causata da una contrazione eccessiva e continua dei muscoli. Nel parkinsonismo la rigidità può essere uniforme (a "tubo di piombo") o a scatti ("a ruota dentata"). La combinazione di tremore e l'aumento del tono muscolare sono considerati l'origine della rigidità a ruota dentata. La rigidità può essere associata a dolore articolare; tale dolore è una frequente manifestazione iniziale della malattia. Nelle fasi iniziali, la rigidità è spesso asimmetrica e tende a influenzare i muscoli del collo e delle spalle, rispetto ai muscoli del viso e degli arti.
L'instabilità posturale è tipica delle ultime fasi. Ciò comporta disturbi dell'equilibrio e frequenti cadute che possono causare fratture ossee. L'instabilità è spesso assente nelle fasi iniziali, soprattutto nelle persone più giovani. Fino al 40% dei pazienti possono andare incontro a cadute e circa il 10% cade settimanalmente, con un numero di cadute correlabile alla gravità della malattia.
La deambulazione avviene tipicamente mediante piccoli passi, strisciati, con un avvio molto problematico e spesso si osserva il fenomeno della "festinazione", cioè la progressiva accelerazione della camminata sino a cadere. Vi possono essere disturbi della deglutizione, il linguaggio può divenire monotono, poco espressivo, lento (bradilalia); la mimica facciale è scarsa e l'espressione impassibile. Anche la scrittura in un certo senso evolve nello stesso modo (micrografia parkinsoniana) con grafia che tende a rimpicciolirsi. Tuttavia, la gamma dei sintomi motori può essere molto più vasta.
Sintomi neuropsichiatrici
La malattia di Parkinson può causare disturbi neuropsichiatrici, che possono essere da lievi a gravi, e che includono disturbi del linguaggio, della cognizione, dell'umore, del comportamento e del pensiero.
Disturbi cognitivi possono verificarsi nelle fasi iniziali della malattia e, talvolta, prima della diagnosi. La prevalenza di essi aumenta con la durata della malattia. Il deficit cognitivo più comune è la disfunzione esecutiva, che può comprendere difficoltà nella pianificazione, nella flessibilità cognitiva, nel pensiero astratto, nell'avvio di azioni appropriate e nell'inibizione delle operazioni inappropriate. Le fluttuazioni dell'attenzione e il rallentamento della velocità cognitiva sono ulteriori problemi a livello cognitivo. La memoria viene influenzata, in particolare, nel ricordare le informazioni apprese. Tuttavia appare un miglioramento quando il richiamo dei ricordi viene aiutato da stimoli.
Una persona con malattia di Parkinson ha un rischio di soffrire di demenza (spesso trattasi di demenza da corpi di Lewy) da 2 a 6 volte maggiore rispetto alla popolazione in generale. La prevalenza della demenza aumenta con il decorso della malattia. La demenza è associata con una forte riduzione della qualità della vita, sia nei pazienti che in chi li assiste. Inoltre, ciò comporta un aumento della mortalità e una maggiore probabilità che si renda necessaria un'assistenza infermieristica.
Alterazioni del comportamento e dell'umore sono più comuni nella malattia di Parkinson rispetto alla popolazione in generale. I problemi più frequenti sono la depressione, l'apatia e l'ansia. Possono verificarsi mania bipolare, e difficoltà nel controllo degli impulsi che può portare all'abuso di farmaci, all'alimentazione compulsiva, all'ipersessualità, al gioco d'azzardo patologico. Questi aspetti sono stati correlati anche ai farmaci usati per combattere la malattia. Sintomi psicotici, come allucinazioni o deliri, si verificano nel 4% dei pazienti e si presume che la causa principale sia un eccesso di dopamina secondario al trattamento, diventano infatti più comuni con l'aumentare dell'età e con l'assunzione di levodopa.
Altri sintomi
Oltre ai sintomi cognitivi e motori, la malattia di Parkinson può compromettere altre funzioni dell'organismo. Problemi di sonno sono una caratteristica della malattia e possono essere aggravati dai farmaci. I sintomi possono manifestarsi con eccessiva sonnolenza diurna, disturbi del sonno nella fase REM o insonnia. Le alterazioni del sistema nervoso autonomo possono portare a ipotensione ortostatica (pressione del sangue bassa in posizione eretta), pelle grassa e eccessiva sudorazione, incontinenza urinaria e alterata funzione sessuale. La costipazione e i disturbi della motilità gastrica, possono essere abbastanza importanti, tanto da creare disagio e mettere in pericolo l'individuo. La condizione comporta alterazioni nella vista, secchezza degli occhi, inseguimento oculare carente l'immagine (difficoltà a mantenere fissa sulla retina l'immagine) e movimenti saccadici (rapidi movimenti involontari di entrambi gli occhi, nella stessa direzione), difficoltà a dirigere lo sguardo verso l'alto e visione offuscata o doppia. Modifiche nella percezione possono comprendere: alterazione dell'olfatto, sensazione di dolore e parestesie (formicolio e intorpidimento della pelle). Tutti questi sintomi possono verificarsi anche per anni prima che venga fatta la diagnosi della malattia.
Diagnosi
Un medico può diagnosticare la malattia di Parkinson partendo dalla storia clinica e da un esame neurologico. Non esiste un test che identifichi chiaramente la malattia, ma scansioni tomografiche cerebrali sono a volte utilizzate per escludere patologie che potrebbero dare luogo a sintomi simili. L'osservazione di corpi di Lewy nel mesencefalo, in sede di autopsia, è solitamente considerata la prova che il paziente soffriva della malattia di Parkinson. Le linee guida consigliano di valutare periodicamente la diagnosi, poiché la progressione della malattia può far cambiare opinione su di essa.
Organizzazioni mediche hanno creato criteri per facilitare e standardizzare il processo diagnostico, soprattutto nelle fasi iniziali della malattia. I più conosciuti provengono dalla britannica Parkinson's Disease Society Brain Bank e dalla statunitense National Institute of Neurological Disorders and Stroke. I criteri del primo istituto citato richiedono la presenza di lentezza nei movimenti (bradicinesia) più rigidità, tremore a riposo o instabilità posturale. Le altre possibili cause di questi sintomi devono essere escluse. Infine, tre o più delle seguenti caratteristiche sono necessarie durante l'insorgenza o l'evoluzione: esordio unilaterale, tremore a riposo, progressione nel tempo, asimmetria dei sintomi motori, risposta alla levodopa per almeno cinque anni, decorso clinico di almeno dieci anni e verificarsi di discinesie indotte dall'assunzione eccessiva di levodopa. La precisione di questi criteri diagnostici, valutati dopo l'autopsia, è del 75-90%, studio accurato della patologia dal punto di vista anatomico e funzionale. Essa sfrutta l'uso di traccianti radioattivi iniettati nell'organismo, i quali vanno a depositarsi nei distretti corporei oggetto di studio, evidenziandone il metabolismo, e quindi in maniera diretta o indiretta, caratteristiche come la vitalità o l'attività. Essendo la malattia di Parkinson una patologia a carico del sistema dopaminergico, i traccianti sono diretti verso il trasportatore della dopamina e verso il trasportatore vescicolare delle monoamine di tipo 2 e verso l'enzima DOPA decarbossilasi (Neuroimaging del sistema dopaminergico). La posizione in cui i traccianti vanno a depositarsi viene rilevata tramite PET e SPECT. Esempi di radiotraccianti utilizzabili sono: lo ioflupane (123I) (nome commerciale DaTSCAN) e iometopane (Dopascan) per la SPECT, il fluorodesossiglucosio (18F-FDG) e la fluoroDOPA per la PET. Un modello sulla riduzione dell'attività dopaminergica nei gangli basali può aiutare nella diagnosi della malattia di Parkinson.
La necessità di un sistema diagnostico rapido, preciso ed economico per il rilevamento di biomarcatori nelle prime fasi delle malattie neurodegenerative ha spinto l’Unione Europea a lanciare un’iniziativa di collaborazione tra istituti di ricerca nel campo delle nanotecnologie per lo sviluppo del NADINE (dall'inglese NAnosystems for early DIagnosis of Neurodegenerative diseases) nel 2010.
Tra i tentativi di successo si riportano l’utilizzo di nanotubi di carbonio a parete singola come elettrodi per il rilevamento simultaneo della presenza di dopamina e adenosina e il simile utilizzo di nanofili di ZnO su spugna di grafene per il rilevamento di biomarcatori del Parkinson quali l’acido ureico, la dopamina e l’acido ascorbico.
L'implementazione di elementi biologici in sensori elettrochimici, chiamati biosensori, ha permesso di ottenere incoraggianti risultati in fatto di limiti di rivelabilità, ma soprattutto in selettività per la determinazione dei livelli di dopamina. In particolare, si riportano l'utilizzo di un biosensore basato sulla tirosinasi, e di un altro basato su un recettore postsinaptico della dopamina.
Diagnosi differenziale
Altre cause che possono secondariamente produrre una sindrome parkinsoniana sono: la malattia di Alzheimer, l'ictus cerebrale e il parkinsonismo farmaco-indotto. Nella diagnosi devono essere escluse sindromi come la paralisi sopranucleare progressiva e l'atrofia sistemica multipla. Tassi di progressione veloci, precoce disfunzione cognitiva o instabilità posturale, tremore minimo o simmetrico all'esordio, possono indicare la presenza di una sindrome ulteriore, piuttosto che la malattia di Parkinson stessa. Le forme genetiche sono di solito classificate come "malattia di Parkinson", anche se i termini di "malattia familiare di Parkinson" e "parkinsonismo familiare" sono utilizzati per i soggetti con malattia autosomica dominante o recessiva.
Terapia
Non esiste una cura per la malattia di Parkinson, ma il trattamento farmacologico, la chirurgia e la gestione multidisciplinare sono in grado di fornire sollievo ai sintomi. I farmaci principalmente utilizzati nel trattamento di sintomi motori sono la levodopa (di solito in combinazione con un inibitore della dopa-decarbossilasi e un inibitore delle COMT), gli agonisti della dopamina e gli inibitori MAO-B (Inibitore della monoamino ossidasi). La fase della malattia determina quale famiglia di farmaci sia più utile. Due fasi sono di solito distinte: una prima fase in cui l'individuo con la malattia ha già sviluppato qualche disabilità e per la quale vi è la necessità di un trattamento farmacologico, una seconda fase in cui in un individuo si sviluppano complicanze motorie legate all'utilizzo della levodopa.
Il trattamento nella fase iniziale ha come obiettivo un compromesso ottimale tra il buon controllo dei sintomi e gli effetti collaterali derivanti dalla valorizzazione della funzione dopaminergica. L'inizio del trattamento con levodopa (o L-DOPA) può essere ritardato utilizzando altri farmaci come gli inibitori MAO-B e gli agonisti della dopamina, nella speranza di ritardare la comparsa delle discinesie. Nella seconda fase l'obiettivo è quello di ridurre i sintomi. Quando i farmaci non sono più sufficienti a controllarli, la chirurgia e la stimolazione cerebrale profonda possono rivelarsi utili. Nelle fasi finali della malattia, le cure palliative vengono offerte per migliorare la qualità di vita.
Levodopa
La Levodopa è il trattamento più ampiamente usato fin dagli anni settanta. L-DOPA è convertito in dopamina nei neuroni dopaminergici (neuroni che producono dopamina) mediante DOPA-decarbossilasi. Poiché i sintomi motori sono prodotti da una mancanza di dopamina nella substantia nigra, la somministrazione di L-DOPA diminuisce temporaneamente i sintomi motori.
Solo il 5-10% dell'L-DOPA attraversa la barriera ematoencefalica. Il resto è spesso metabolizzato altrove in dopamina, provocando una serie di effetti collaterali tra cui nausea, discinesia e rigidità articolare. La carbidopa e la benserazide sono inibitori periferici della DOPA-decarbossilasi, che aiutano a bloccare il metabolismo della L-DOPA, prima che raggiunga i neuroni dopaminergici, riducendo pertanto gli effetti collaterali e aumentando la biodisponibilità. Essi sono generalmente somministrati in preparazioni associate alla levodopa. I preparati esistenti sono carbidopa/levodopa (co-careldopa) e benserazide/levodopa (co-beneldopa). La levodopa è stata correlata alla sindrome da disregolazione dopaminergica, che consiste in un uso eccessivo e compulsivo del farmaco. Vi sono alcune versioni a rilascio controllato e lento di levodopa, tuttavia esse non hanno mostrato un maggiore controllo dei sintomi e delle complicanze motorie rispetto a preparazioni a rilascio immediato.
Il tolcapone inibisce l'enzima COMT, degradante la dopamina, prolungando gli effetti della levodopa. Tuttavia, la sua utilità è limitata da effetti collaterali, come ad esempio i possibili danni al fegato. L'uso dell'entacapone, un farmaco altrettanto efficace, non evidenzia alterazioni significative della funzionalità epatica.
I preparati a base di levodopa portano a lungo termine allo sviluppo di complicanze motorie caratterizzate da movimenti involontari chiamati discinesie e fluttuazioni nella risposta al trattamento farmacologico. In questo caso, un paziente affetto da malattia di Parkinson può sperimentare dei periodi con buona risposta ai farmaci con alcuni sintomi (fase on) e periodi con nessuna risposta al trattamento e sintomi motori significativi (fase off). Per questo motivo, le dosi di levodopa vengono somministrate in quantità minime. È pratica comune ritardare l'inizio della terapia con levodopa utilizzando alternative, come gli agonisti dopaminergici e gli inibitori della monoamino ossidasi. Una strategia utilizzata in passato per ridurre le complicanze motorie era quella di sospendere il trattamento con L-DOPA per un certo tempo. Ora ciò è sconsigliato, dal momento che può portare a effetti collaterali pericolosi, come la sindrome neurolettica maligna.
Agonisti dopaminergici

Numerosi agonisti della dopamina, che si legano ai recettori dopaminergici post-sinaptici del cervello, hanno effetti simili a quelli della levodopa.. Inizialmente venivano usati, come terapia complementare alla levodopa, negli individui che accusano fluttuazioni on-off e discinesie, ora sono utilizzati principalmente come terapia unica iniziale per i sintomi motori, con l'obiettivo di ritardare l'assunzione di levodopa e le sue complicazioni motorie. Gli agonisti dopaminergici stimolano, con diversa specificità rispetto ai diversi tipi, i recettori per la dopamina. Si dividono in ergolinici (bromocriptina, pergolide, lisuride, cabergolina) e non ergolinici (pramipexolo, ropinirolo, apomorfina).
Gli agonisti della dopamina producono significativi, anche se di solito lievi, effetti collaterali, tra cui sonnolenza, allucinazioni, insonnia, nausea e stipsi. A volte gli effetti collaterali appaiono anche con una minima dose clinicamente efficace, che porta il prescrivente alla ricerca di un farmaco diverso. Rispetto alla levodopa, gli agonisti della dopamina possono ritardare le complicanze motorie, ma sono meno efficaci nel controllare i sintomi. Tuttavia, solitamente appaiono sufficienti per gestire i sintomi nei primi anni di malattia. Essi tendono ad essere più costosi della levodopa. Tali farmaci sono stati correlati a disturbi del controllo degli impulsi, come l'ipersessualità, l'alimentazione compulsiva e il gioco d'azzardo e lo shopping patologici, in maniera anche più importante rispetto alla levodopa.
Apomorfina, un agonista della dopamina, somministrata attraverso iniezioni sottocutanee, può essere utilizzata nella malattia avanzata per ridurre le fasi off e la discinesia. Dato che gli effetti secondari, come la confusione e le allucinazioni sono comuni, i pazienti che ricevono l'apomorfina devono essere attentamente monitorati. Recentemente sono stati trovati due agonisti della dopamina che vengono somministrati attraverso cerotti (lisuride e rotigotina) e risultano essere utili nei pazienti nella fase iniziale della malattia, mentre vi sono ancora degli studi alla fase preliminare riguardo alla loro efficacia nei pazienti in stato avanzato.
Inibitori della monoamino ossidasi

Gli inibitori della monoamino ossidasi (inibitori MAO-B), safinamide, selegilina e rasagilina, sono in grado di aumentare il livello di dopamina nei gangli della base, bloccandone il metabolismo. Essi bloccano la deaminazione ossidativa delle ammine endogene catalizzata dalle monoaminossidasi mitocondriali. La riduzione della attività della monoamino ossidasi, comporta un aumento di L-DOPA nello striato. Come gli agonisti della dopamina, gli inibitori MAO-B sono utilizzati in monoterapia per migliorare i sintomi motori e ritardare la necessità di assumere levodopa nella malattia precoce, ma producono effetti più negativi e sono meno efficaci rispetto alla levodopa. Vi sono pochi studi sulla loro efficacia in fase avanzata, anche se i risultati suggeriscono che essi sono utili per ridurre le fluttuazioni tra le fasi on e off. Uno studio iniziale ha indicato che la selegilina, in associazione con levodopa, aumenta il rischio di morte, ma ciò è stato in seguito smentito.
Altri farmaci
Altri farmaci, come l'amantadina e gli anticolinergici, possono essere utili nel trattamento dei sintomi motori. Tuttavia, le prove a loro sostegno mancano di qualità e ciò comporta che non siano considerati trattamenti di prima scelta. Oltre ai sintomi motori, la malattia di Parkinson è accompagnata da una vasta gamma di sintomi. Un certo numero di farmaci sono stati utilizzati per il trattamento di alcuni di questi problemi. Ne sono un esempio l'uso della clozapina nella psicosi, degli inibitori della colinesterasi per la demenza e il modafinil per l'eccessiva sonnolenza diurna. Una meta-analisi del 2010, ha riscontrato che l'uso di farmaci anti-infiammatori non steroidei (tranne il paracetamolo e l'aspirina), sono stati correlati ad almeno il 15% di una minore incidenza di sviluppo della malattia di Parkinson.
Terapia chirurgica

Una volta, trattare i sintomi motori con un intervento chirurgico, era una pratica comune, ma dal momento che venne scoperta la levodopa, il numero degli interventi diminuì. Gli studi degli ultimi decenni hanno portato a grandi miglioramenti nelle tecniche chirurgiche, con la conseguenza che la chirurgia è nuovamente utilizzata nelle persone sofferenti la malattia di Parkinson e per le quali la terapia farmacologica non è più sufficiente. Attualmente la tecnica più utilizzata è la chirurgia stereotassica che permette di trattare punti in profondità nel parenchima cerebrale con precisione millimetrica, grazie all'ausilio di dispositivi radiologici. Il trattamento chirurgico per la condizione, può essere distinto in due gruppi principali: stimolazione cerebrale profonda (Deep Brain Stimulation, DBS) o intervento lesionale. I settori di intervento sono il talamo, il globo pallido o il nucleo subtalamico.
La stimolazione cerebrale profonda (DBS) è il trattamento chirurgico più comunemente utilizzato e permette una buona remissione clinica e una significativa riduzione della dipendenza da levodopa. Esso comporta l'impianto di un dispositivo medico, chiamato pacemaker cerebrale, che invia impulsi elettrici a zone specifiche del cervello. La DBS è raccomandata per i pazienti con Parkinson che soffrono di forte tremore che non viene adeguatamente controllato da farmaci o in coloro che sono intolleranti al trattamento farmacologico. Uno studio pubblicato nel Journal of the American Medical Association ed effettuato su un campione di 225 malati, ha evidenziato, nel 71% dei casi, decisivi miglioramenti nei movimenti e nella diminuzione dei tremori in seguito alla DBS, rispetto al 32% che prendeva solo farmaci.
Altre, ma meno comuni, terapie chirurgiche comportano la creazione di lesioni in specifiche aree sottocorticali (una tecnica nota come pallidotomia, nel caso che la lesione sia prodotta nel globo pallido).
Riabilitazione
Nonostante gli studi al riguardo siano scarsi e di bassa qualità, l'esperienza fornisce alcune prove che i problemi di linguaggio e di mobilità sono in grado di migliorare grazie alla riabilitazione. L'esercizio fisico regolare, specialmente con la fisioterapia, può essere utile per mantenere e migliorare la mobilità, la flessibilità, la forza, l'andatura e la qualità della vita. Inoltre, quando un programma di esercizio viene svolto sotto la supervisione di un fisioterapista, si possono riscontrare maggiori miglioramenti sia nella mobilità, che nelle funzioni mentali ed emotive, che nelle attività quotidiane della vita.
Per migliorare la capacità di movimento nei pazienti che presentano rigidità, sono stati proposti esercizi e tecniche di rilassamento, come dolci dondolii, che aiutano a diminuire l'eccessiva tensione muscolare. Altre efficaci tecniche includono lenti movimenti di rotazione degli arti e del tronco, la respirazione diaframmatica e tecniche di meditazione. Per quanto riguarda la deambulazione, i fisioterapisti possono proporre una serie di strategie per migliorare la mobilità e la sicurezza funzionale. Queste puntano a migliorare la velocità di andatura, la lunghezza del passo, il movimento del tronco e del braccio. Gli esercizi studiati per rafforzare la muscolatura si sono dimostrati utili per migliorare la funzionalità motoria nei pazienti con debolezza muscolare e debolezza relativa all'inattività. Tuttavia, i rapporti mostrano una significativa interazione tra la forza e il momento in cui sono stati assunti i farmaci. Pertanto, si raccomanda che i pazienti eseguano gli esercizi da 45 minuti a un'ora dopo l'assunzione dei medicinali, ovvero quando la condizione del paziente è ottimale. Inoltre, a causa della postura flessa in avanti e delle disfunzioni respiratorie presenti nella fase avanzata della malattia, gli esercizi di respirazione profonda diaframmatica sono utili per migliorare la mobilità della parete toracica e della funzionalità vitale. L'attività fisica può migliorare la stitichezza.
Uno dei trattamenti più ampiamente praticati per i disturbi del linguaggio associati al morbo di Parkinson è la terapia vocale con il metodo Lee Silverman (LSVT). La logopedia e in particolare la LSVT possono migliorare il linguaggio. La terapia occupazionale mira a promuovere la salute e la qualità della vita, aiutando le persone con la malattia a compiere molte delle loro attività della vita quotidiana il più autonomamente possibile. Gli studi sull'efficacia della terapia occupazionale sono ancora pochi, nonostante ciò, vi sono prove che essa possa migliorare le capacità motorie e la qualità della vita dei pazienti affetti dalla malattia di Parkinson.
Alimentazione
I muscoli e i nervi che controllano la digestione possono essere influenzati dalla malattia, con conseguente costipazione e gastroparesi (il cibo rimane nello stomaco per un periodo di tempo più lungo del normale). Un'alimentazione equilibrata, sulla base di periodiche valutazioni nutrizionali, è consigliata e deve essere finalizzata ad evitare la perdita o il guadagno di peso e a ridurre al minimo le conseguenze delle disfunzioni gastrointestinali. Con l'avanzare della malattia, può comparire la disfagia, ossia la difficoltà nella deglutizione. In questi casi può essere utile usare addensanti per l'assunzione di liquidi e assumere una postura eretta quando si mangia, poiché entrambe le misure riducono il rischio di soffocamento. Nei casi più gravi si può ricorrere alla gastrostomia per far giungere il cibo direttamente nello stomaco.
Il farmaco levodopa e le proteine utilizzano, in concorrenza, lo stesso sistema di trasporto nell'intestino e nella barriera emato-encefalica. Questo comporta che, se assunti insieme, l'efficacia del farmaco appaia ridotta. Pertanto, quando si fa uso di levodopa, si sconsiglia il consumo eccessivo di proteine e viene raccomandata una dieta mediterranea equilibrata. Negli stadi avanzati, l'assunzione supplementare di prodotti ipoproteici, come pane o pasta, viene consigliata per ragioni analoghe. Per minimizzare l'interazione con le proteine, la levodopa deve essere assunta 30 minuti prima dei pasti.
Le cure palliative
Il ricorso alle cure palliative è spesso richiesto nelle fasi finali della malattia, quando tutte le altre strategie di trattamento sono diventate inefficaci. Lo scopo delle cure palliative è quello di ottimizzare la qualità della vita, sia per il paziente che per tutti quelli che lo circondano. Alcuni obiettivi centrali delle cure palliative sono: cure adeguate nella propria comunità, riduzione o sospensione dell'assunzione dei farmaci per ridurre gli effetti collaterali, prevenzione delle piaghe da decubito nei pazienti allettati, supporto per il paziente e per le persone a lui vicine.
Altri trattamenti
È stato dimostrato che la stimolazione magnetica transcranica migliora temporaneamente la discinesia indotta dalla levodopa. La sua utilità nel trattamento della malattia di Parkinson è un argomento di ricerca ancora aperto, anche se studi recenti non hanno dimostrato alcun effetto. Diversi principi nutritivi sono stati proposti come possibili trattamenti, ma non vi sono prove che le vitamine o gli additivi alimentari siano in grado di migliorare i sintomi. Non vi sono prove a sostegno che l'agopuntura e la pratica del Qigong o del T'ai chi abbiano alcun effetto sul decorso della malattia o sulla presentazione dei sintomi. Tuttavia, sono necessarie ulteriori ricerche sul T'ai chi quando viene utilizzato al fine di migliorare la capacità di equilibrio. La mucuna pruriens e la vicia faba sono fonti naturali di levodopa e sono assunte da molte persone con la malattia. Sebbene in alcuni studi clinici si sia dimostrata una certa efficacia, la loro ingestione non è esente da rischi. Sono state, infatti, riportate delle reazioni avverse letali, come la sindrome neurolettica maligna.
Prognosi

nessun dato
< 5
5–12.5
12.5–20
20–27.5
27.5–35
35–42.5
42.5–50
50–57.5
57.5–65
65–72.5
72.5–80
> 80
La malattia di Parkinson progredisce sempre con il tempo. La scala di Hoehn e Yahr, che definisce cinque stadi di progressione, è comunemente usata per stimare l'avanzamento della malattia.
I sintomi motori, se non trattati, progrediscono in modo aggressivo nelle fasi iniziali della malattia e più lentamente in seguito. Se non trattati, si può prevedere che i pazienti vadano incontro a una perdita della deambulazione indipendente in media dopo otto anni e siano costretti a letto dopo dieci anni. Tuttavia, è raro, al giorno d'oggi, trovare persone che non ricevano un trattamento. I farmaci hanno migliorato la prognosi dei sintomi motori, mentre allo stesso tempo vi è una nuova fonte di disabilità a causa degli effetti indesiderati della levodopa, che si verificano dopo anni di utilizzo. Per le persone che assumono levodopa, il tempo di progressione dei sintomi – dall'esordio a una fase di completa non autosufficienza – può essere di oltre i 15 anni. Tuttavia, è difficile prevedere il decorso della malattia per un dato paziente. L'età è il miglior predittivo della progressione della malattia. Il deficit cognitivo è più frequente in coloro che hanno più di 70 anni di età all'insorgenza dei sintomi.
Dal momento che le attuali terapie sono in grado di migliorare i sintomi motori, la disabilità è principalmente collegata alle caratteristiche non-motorie della malattia. Tuttavia, il rapporto tra la progressione della malattia e la disabilità non è lineare. Inizialmente la disabilità è legata ai sintomi motori, con l'avanzare della malattia essa risulterà più correlata con i sintomi che non rispondono adeguatamente al trattamento farmacologico, come ad esempio la deglutizione, la difficoltà di parola e di equilibrio. Inoltre vi è da tener conto delle complicanze relative al movimento, che appaiono nel 50% degli individui dopo 5 anni di utilizzo di levodopa. Infine, dopo dieci anni, la maggior parte dei pazienti sperimenta dei disturbi autonomici (ovvero del sistema nervoso autonomo), disturbi del sonno, alterazioni dell'umore e declino cognitivo. Tutti questi sintomi, in particolare il declino cognitivo, aumentano notevolmente la disabilità.
Scala di Hoehn e Yahr
La scala di Hoehn e Yahr è comunemente usata per descrivere i sintomi della progressione della malattia di Parkinson. È stata originariamente pubblicata nel 1967 sulla rivista Neurology da Melvin Yahr e Margaret Hoehn e comprendeva gli stadi da 1 a 5. Da allora, è stata proposta una scala modificata, con l'aggiunta degli stadi 1,5 e 2,5 che descrivono il decorso intermedio della malattia.
| Stadio | Scala di Hoehn e Yahr | Scala di Hoehn e Yahr modificata |
|---|---|---|
| 1 | Coinvolgimento unilaterale, solitamente con solo una minima o nessuna disabilità funzionale | Solo coinvolgimento unilaterale |
| 1.5 | - | Coinvolgimento unilaterale e assiale |
| 2 | Coinvolgimento bilaterale o mediano senza compromissione dell'equilibrio | Coinvolgimento bilaterale senza compromissione dell'equilibrio |
| 2.5 | - | Lieve coinvolgimento bilaterale senza recupero sul test a trazione |
| 3 | Coinvolgimento bilaterale da medio a moderato; alcune difficoltà posturali; fisicamente indipendente | Da lieve a moderato coinvolgimento bilaterale; instabilità posturale; fisicamente autosufficiente |
| 4 | Malattia gravemente debilitante, ancora in grado di camminare o stare in piedi senza assistenza | Grave disabilità; ancora in grado di camminare o stare in piedi senza assistenza |
| 5 | Costretto a letto o sulla sedia a rotelle | Costretto a letto o sulla sedia a rotelle |
Mortalità
L'aspettativa di vita dei malati di Parkinson appare ridotta. I tassi di mortalità sono circa il doppio di quelli delle persone non affette. Il declino cognitivo e la demenza, l'esordio in vecchiaia, uno stato di malattia più avanzato e la presenza di problemi nella deglutizione, sono tutti fattori che aumentano il rischio di mortalità. D'altra parte, una malattia caratterizzata principalmente da tremore rispetto alla rigidità, prevede una sopravvivenza più lunga. La morte da polmonite ab ingestis è due volte più frequente nei soggetti con malattia di Parkinson rispetto alla popolazione sana.
Società e cultura
Costi
La malattia di Parkinson costituisce un costo sociale molto elevato, ma è difficile determinare dati precisi sia per problemi metodologici nella stima che per le differenze esistenti tra i vari paesi. Il costo annuale nel Regno Unito è stimato tra i 449 milioni e i 3,3 miliardi di sterline, mentre il costo annuale per paziente negli Stati Uniti si aggira intorno ai $ 10 000, per un totale di circa 23 miliardi di dollari. Sebbene non esista alcun'analisi dell'impatto economico della malattia in Italia, si può stimare una spesa annuale totale intorno ai 2,4 miliardi di euro.
La quota maggiore del costo diretto viene dai ricoveri e dai soggiorni nelle case di cura, mentre la parte proveniente dai farmaci è sostanzialmente inferiore. Anche i costi indiretti sono elevati, per via della riduzione della produttività e degli oneri che ricadono su chi assiste i pazienti. Oltre ai costi economici, la malattia riduce la qualità della vita di coloro che ne soffrono e di chi li assiste.
Patrocini
L'11 aprile, l'anniversario della nascita di James Parkinson, è stato designato come il giorno dedicato alla malattia. Un tulipano rosso è stato scelto, nel 2005, dalle organizzazioni internazionali come simbolo della malattia. Tra le più importanti organizzazioni di rappresentanza e difesa vi sono le statunitensi National Parkinson Foundation, che ha destinato più di 155 milioni di dollari per la cura, la ricerca e i servizi di supporto dal 1982, la Parkinson Disease Foundation, che ha devoluto più di 90 milioni di dollari per la ricerca e 37 milioni di dollari per programmi di educazione e sensibilizzazione fin dalla sua fondazione avvenuta nel 1957, l'American Parkinson Disease Association, fondata nel 1961, e l'Associazione Europea per il Morbo di Parkinson, fondata nel 1992.
Personaggi famosi colpiti dalla malattia che hanno contribuito alla ricerca

La rivelazione dell'attore Michael J. Fox di essere affetto dalla malattia di Parkinson ha notevolmente aumentato la consapevolezza pubblica della malattia. A Fox è stata diagnosticata nel 1991, quando aveva 30 anni, ma la sua condizione è stata tenuta nascosta per sette anni. L'attore ha scritto due autobiografie incentrate sulla sua lotta contro la malattia. La Fondazione Michael J. Fox mira a sviluppare una cura per il morbo di Parkinson. Negli ultimi anni è stata la principale organizzazione impegnata nella raccolta fondi negli Stati Uniti per la malattia di Parkinson, riuscendo a ridistribuire finanziamenti per 140 milioni di dollari tra il 2001 e il 2008. Nel 2007 Fox è stato nominato secondo la rivista TIME tra le 100 persone "il cui potere, talento o esempio morale stanno trasformando il mondo", e ha ricevuto la laurea honoris causa in medicina dal Istituto Karolinska per i suoi contributi alla ricerca nella malattia di Parkinson.
Una fondazione che sostiene la ricerca sul Parkinson, puntando sulla qualità della vita dei pazienti, è sorta nel 2004 ad opera del ciclista professionista e olimpionico Davis Phinney, a cui a 40 anni è stata diagnosticata la malattia. L'obiettivo della The Davis Phinney Foundation è aiutare le persone affette dal morbo a vivere bene, fornendo loro informazioni, presidi e supporto.
Stato della ricerca
Ci sono poche possibilità che in un breve lasso di tempo vengano introdotti nuovi trattamenti rivoluzionari per la malattia di Parkinson. Gli attuali campi di ricerca includono nuovi studi su modelli animali, sulle potenzialità della terapia genica, sul trapianto di cellule staminali e sugli agenti neuroprotettivi.
Modelli animali
In natura, la malattia di Parkinson non si verifica in specie diverse dagli esseri umani. Cavie animali che mostrano alcune caratteristiche della malattia sono utilizzate nella ricerca. La comparsa dei sintomi parkinsoniani, avvenuta nei primi anni ottanta, in un gruppo di tossicodipendenti che avevano consumato una partita di oppiacei contaminati da MPPP, ha portato alla scoperta dell'MPTP come un agente causale della sindrome parkinsoniana nei primati, nonché negli esseri umani.
Altri esperimenti incentrati su tossine hanno visto impiegare l'insetticida rotenone, il diserbante paraquat e il fungicida maneb. Queste prove sono state principalmente fatte su primati. Inoltre, sono stati impiegati particolari specie di roditori transgenici che riproducono i vari aspetti della malattia di Parkinson.
Terapia genica
La terapia genica comporta l'uso di virus non infettivi per portare un gene in una parte del cervello. Il virus con il gene viene iniettato in una zona precisa del cervello, il nucleo subtalamico, che regola il circuito motorio. Il gene serve per produrre il neurotrasmettitore GABA che è deficitario nei pazienti affetti da Parkinson. Iniettando il gene per il GABA all'interno del cervello, i ricercatori hanno tentato di stimolare la produzione del neurotrasmettitore per normalizzare la funzione del circuito motorio.
Nel 2010 vi erano quattro studi clinici che avevano utilizzato la terapia genica nella malattia di Parkinson. Non vi sono stati importanti effetti negativi in questi studi, anche se l'utilità clinica della terapia genica è ancora da determinare. Un ulteriore risultato positivo è stato riportato nel 2011.
Recentemente, altre promettenti ricerche indicano la possibilità di usare tecniche di ingegneria genetica per "infettare" opportunamente i mitocondri di cellule dopaminergiche di topi con una proteina (beta 2.7) in grado di proteggere gli stessi dall'insulto e in definitiva rendendo più resistenti le stesse cellule al danno apoptotico.
Trattamenti neuroprotettivi

Gli studi su trattamenti neuroprotettivi sono all'avanguardia nella ricerca sulla malattia di Parkinson. Sono stati proposti trattamenti con varie molecole, ma nessuno di essi si è dimostrato capace di ridurre la degenerazione in modo definitivo. Il farmaco neuroprotettivo più conosciuto e utilizzato è la selegilina (Deprenyl). La selegilina è un inibitore irreversibile della MAO-B che ha un effetto antiossidante, neurotrofico e antiapoptotico. Ulteriori agenti attualmente sotto studio sono gli anti-apoptotici (omigapil, CEP-1347), l'acido glutammico, gli inibitori delle monoaminossidasi (la rasagilina e la già citata selegilina), farmaci favorenti la funzione mitocondriale (coenzima Q10 e la creatina), i calcio-antagonisti (isradipina) e il fattore di crescita neurotrofico derivato dalle cellule gliali. La ricerca preclinica si rivolge anche alla alfa-sinucleina. Un vaccino che predisponga il sistema immunitario umano a distruggere l'alfa-sinucleina, il PD01A (sviluppato dalla società austriaca, Affiris), è entrato negli studi clinici sugli esseri umani.
Terapia con cellule staminali
Fin dal 1980, sono stati tentati trapianti di cellule staminali nella substantia nigra, nella speranza che esse potessero sostituirsi alle cellule nervose degenerate e quindi riprendere la produzione di dopamina. Anche se alcuni studi iniziali hanno considerato la tecnica come promettente, studi più recenti tuttavia non hanno dimostrato alcun beneficio a lungo termine. Un problema significativo è stato il rilascio eccessivo di dopamina da parte del tessuto trapiantato, con conseguenti distonie.
I trapianti di cellule staminali sono oggetto di importanti ricerche che hanno già presentato alcuni risultati positivi. La scoperta che tali cellule, se stimolate in vitro con il prodotto del gene NURR1 si differenziavano in cellule dopaminergiche, e che queste, se introdotte per via stereotassica nel cervello di ratti affetti da malattia di Parkinson ne rallentavano la progressione fino all'arresto, ha aperto orizzonti rivoluzionari nel trattamento della malattia. Tuttavia, l'utilizzo di cellule staminali embrionali è controverso da un punto di vista etico. È stato perciò proposto di incentrare la ricerca sull'utilizzo delle cellule staminali pluripotenti indotte.
Progetti informatici di calcolo distribuito
L'iniziativa Folding@home, un progetto informatico di calcolo distribuito, propone di migliorare la comprensione della malattia di Parkinson, sfruttando la potenza di calcolo dei personal computer dei volontari.
Bibliografia
- Angiolino Guerrini, Parkinson Insieme, Bordeaux Edizioni, 2011, ISBN 978-88-97236-00-9.
- Ubaldo Bonuccelli, La malattia di Parkinson. Diagnosi e terapia all'esordio, Primula Multimedia, 1999, ISBN 88-87344-11-6.
- Diego De Leo, Manuale di Psichiatria dell'Anziano, Piccin, 1994.
- Cornelio Fazio, Carlo Loeb e Emilio Favale, Neurologia, Società Editrice Universo, 2003, ISBN 88-87753-73-3.
- Luigi Ravizza, Invecchiamento cerebrale e demenze, Elsevier srl, 2004, ISBN 978-88-214-2716-9.
- (EN) Douglas M. Anderson e Elliot Michelle, Mosby's medical, nursing, & Allied Health Dictionary sesta edizione, New York, Piccin, 2004, ISBN 88-299-1716-8.
- (EN) The National Collaborating Centre for Chronic Conditions, Parkinson's Disease, Londra, Royal College of Physicians, 2006, ISBN 1-86016-283-5. URL consultato il 26 settembre 2012 (archiviato dall'url originale il 24 settembre 2010).
- (EN) Susan B. O'Sullivan e Thomas J. Schmitz, Parkinson's Disease, in Physical Rehabilitation, 5ª ed., Philadephia, F.A. Davis, 2007, ISBN 978-0-8036-1247-1.
- (EN) Murray Longmore, Ian Wilkinson, Tom Turmezei e Chee Kay Cheung, Oxford Handbook of Clinical Medicine, Oxford University Press, 2007, ISBN 978-0-19-856837-7.
- (EN) Joseph Jankovic e Eduardo Tolosa, Parkinson's disease and movement disorders, Hagerstown, MD, Lippincott Williams & Wilkins, 2007, ISBN 0-7817-7881-6.
- (EN) Gregory Cooper, Gerald Eichhorn e Robert Rodnitzky, Parkinson's disease, in Neuroscience in medicine, Totowa, NJ, Humana Press, 2008, ISBN 978-1-60327-454-8.
- (EN) IOM (Institute of Medicine), Neurologic disorders, in Veterans and Agent Orange: Update 2008, Washington D.C., The National Academies press, 2009, ISBN 0-309-13884-1.
- (EN) Marie Banich e Rebecca Compton, Motor control, in Cognitive neuroscience, Belmont, CA, Wadsworth, Cengage learning, 2011, ISBN 0-8400-3298-6.
- William O. Foye, Thomas L. Lemke; David A. Williams, Principi di chimica farmaceutica, 5ª ed., Padova, Piccin, maggio 2011, ISBN 978-88-299-2034-1.
- (EN) David Eidelberg, Imaging in Parkinson's Disease, Oxford University Press, 2011, ISBN 978-0-19-539348-4.
Voci correlate
Altri progetti
Altri progetti
-
 Wikiquote contiene citazioni di o su malattia di Parkinson
Wikiquote contiene citazioni di o su malattia di Parkinson
-
 Wikimedia Commons contiene immagini o altri file su malattia di Parkinson
Wikimedia Commons contiene immagini o altri file su malattia di Parkinson
Collegamenti esterni
- (EN) Malattia di Parkinson, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Parkinson.it, il sito italiano sulla malattia di Parkinson, su parkinson.it.
- Progetti di ricerca della Fondazione Grigioni per il Morbo di Parkinson, su parkinson.it.
- il sito italiano sul Parkinson giovanile, su parkinsongiovani.com.
- Cura della Malattia di Parkinson, su sites.google.com.
- Malattia di Parkinson, Parkinsonismi, Cura e Risonanza Magnetica, su sites.google.com.
- (EN) Stemcells.nih.gov.
- (EN) Parkinson's Disease: symptoms, diagnosis, biochemistry, causes, treatments, history, prevalence, organisations, toxic causes, genetic causes, su shorterlink.com.
|
Classificazione e risorse esterne (EN) |
ICD-9-CM: 332.0 e 332; ICD-10-CM: G20 e F02.3; OMIM: 168600; MeSH: D010300; DiseasesDB: 9651;
MedlinePlus: 000755;eMedicine: 1831191;GeneReviews: Malattia di Parkinson panoramica; |
| Controllo di autorità | Thesaurus BNCF 17148 · LCCN (EN) sh85098118 · GND (DE) 4044683-9 · BNE (ES) XX528689 (data) · BNF (FR) cb119760133 (data) · J9U (EN, HE) 987007565523505171 · NSK (HR) 000175745 · NDL (EN, JA) 00571142 |
|---|

